यहाँ हमने Class 12 Chemistry Chapter 8 Notes in Hindi दिये है। Class 12 Chemistry Chapter 8 Notes in Hindi आपको अध्याय को बेहतर ढंग से समझने में मदद करेंगे और आपकी परीक्षा की तैयारी में सहायक होंगे।
Class 12 Chemistry Chapter 8 Notes in Hindi d एवं f ब्लॉक के तत्व
d ब्लाक के तत्व (संक्रमण तत्व ):-
- वे तत्व जिनके परमाणुओ में आने वाला अन्तिम इलेक्ट्रॉन d कक्षक में भरे जाते है, इन तत्वो में (n-1)d उपकोश आंशिक भरे होते है या इनमे आने वाला इलेक्ट्रॉन (n-1)d उपकोश में प्रवेश करता है, d ब्लाक के तत्व कहलाते है।
- d ब्लाक तत्व को संक्रमण तत्व भी कहते है क्योकि ये तत्व दीर्घाकार आवर्त सारणी में 5 व p ब्लाक तत्वो के मध्य मे पाये जाते है।
- संक्रमण तत्वो की चार पंक्तियां अर्थात 3d, 4d, 5d व 6 d प्राप्त होती है।
प्रथम संक्रमण श्रेणी (First Transition Series ):-
- इस श्रेणी को 3d संक्रमण श्रेणी भी कहते है।
- इस श्रेणी में 10 तत्व होते है (परमाणु संख्या 21 से 30 तक)।
- इस श्रेणी के तत्व निम्न है – Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn
- इनमे अपूर्ण 3d उपकोश होते है जबकि 4s कक्षक मे दो अथवा एक एक इलेक्ट्रान होते है।
- इस श्रेणी का सामान्य इलेक्ट्रानिक विन्यास 3d1-10 4s1-2 होता है।
द्वितीय संक्रमण श्रेणी (Second Transition Series):-
- ये श्रेणी 4d संक्रमण श्रेणी भी कहलाती है।
- इस श्रेणी में 10 तत्व होते है (परमाणु क्रमक 39 से 48 तक)
- इस श्रेणी के तत्व हैं:- Y, Zr, Nb, Mo, Tc, Ru, Rn, Pd, Ag, Cd
- इसमें अपूर्ण 4d उपकोश होते है।
- इस श्रेणी का सामान्य e– विन्यास 4d1-10 5s0-2
तृतीय संक्रमण श्रेणी (3rd Transition series):-
- इसे 5d संक्रमण श्रेणी भी कहते हैं।
- इसमें 10 तत्व होते हैं। (परमाणु संख्या 57, फिर 72 से 80 तक)
- इस श्रेणी के तत्व है:- La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg
- इसमें अपूर्ण 5d उपकोश होते है। इस श्रेणी का सामान्य e– विन्यास 5d1-10 6s1-2 होता है।
चतुर्थ संक्रमण श्रेणी:-
- इसे 6d– संक्रमण श्रेणी भी कहते है।
- इस श्रेणी में भी 10 तत्व आते है। Ac, Rf, Db, g, Bh, Hs, Mf, Ds, Rg, Uub
- इनका इलेक्ट्रानिक विपास 6d1-10 7s1-2 होता है।
- इनका इलेक्ट्रानिक विन्यास 6d1-10 7s1-2 होता है।
- संक्रमण तत्वो को आवर्त सारणी में s व p ब्लॉक के मध्य रखा गया है इन्हें IIIB, IVB, VB, VIB, VIIB, VIII [3 भाग ] तथा IB व IIB में रखा गया है।
इलेक्ट्रानिक विन्यास:-
- इन तत्वो का सामान्य इलेक्ट्रानिक विन्यास 6d1-10 7s1-2 (n-1) d1-10 ns1-2 होता है।
- (n -1) d आन्तरिक d कक्षको को प्रदर्शित करता है।
- वर्ग 12 के तत्वो Zn, Cd, Hg की सामान्य अथवा आयनिक किसी भी अवस्था मे केवल एक ही कोश अपूर्ण होता है। अत: ये संक्रमण तत्व नही कहलाते है।
संक्रमण तत्वों के सामान्य अभिलक्षण:-
- सभी संक्रमण तत्व उत्प्रेरक का कार्य करती है।
- संक्रमण धातुऐ एक से अधिक ऑक्सीकरण अवस्थाएं प्रदर्शित करती है।
- ये मिश्रधातु व अन्तराकाशी यौगिक बनाने की प्रवृत्ति रखते है।
- सामान्यत: इन तत्वो में रंगीन यौगिक बनाने की प्रवृत्ति होती है।
- इनकी क्रियाशीलता 5 व p ब्लाक तत्वो के मध्य होती है।
- मर्करी को छोड़कर जो कमरे के ताप पर द्रव हैं, अन्य सभी संक्रमण तत्व ठोस होते है।
- ये सभी तत्व कठोर, अघातवर्धनीय, तन्य, उच्च गलनांक व क्वथनांक वाले विद्युत व ऊष्मा के सुचालक होते है।
- ये सभी तत्व धातु है तथा इनमें धन विद्युती गुन होते है।
- इनके आयन संकुल यौगिक बनाने की प्रवृत्ति रखते है।
d – ब्लाक (संक्रमण तत्वो) के सामान्य गुण :-
(1) धात्विक अभिलक्षण:- ये सभी तत्व धातु है, ये कठोर उच्च तनन सामर्थ्य तन्यता, अघातवर्ध्य, उच्च तापीय एवं विद्युत चालकता एवं धालिक चमक दर्शाते है। अपूर्ण d – उपकोशो की उपस्थिति के कारण इनके मध्य सहसंयोजक बल व धात्विक दोनो प्रकार के कार्य करते है जो इनके परमाणुओ को आपस मे प्रबलता से बांधे रखते है। यही कारण है कि इनके गलनांक क्वथनांक s तथा p – ब्लाक के तत्वो की अपेक्षा उच्च होते है।
तत्वों Zn, Cd, Hg में (n-1) d उपकोश में अयुग्मित इलेक्ट्रॉन अनुपस्थित होते है अत: इनमें धात्विक आबन्ध होते है, जिस कारण इनके गलनांक व क्वथनांक निम्न होते है।
(2) परिवर्ती संयोजकता:– ये तत्व परिवर्ती संयोजकता प्रदर्शित करते है क्योंकि इनके ns व (n-1) d दोनो कक्षको के e– रासायनिक बंध बनाने में लेते हैं जिससे ये अनेक ऑक्सीकरण अवस्थाये प्रदर्शित करते है।
(3) रंगीन आयन:- इनके आपन रंगीन होते हैं क्योकि इनमे (n-1) d उपकोश अपूर्ण होता है, जिनके अयुग्मित e– दृश्य क्षेत्र से प्रकाश अवशोषित करके निम्न ऊर्जा स्तर से उच्च ऊर्जा स्तर में चले जाते हैं जहां ये d’-d संक्रमण द्वारा रंग उत्पन्न करते हैं।
(4) आयनिक त्रिज्याएं:- संक्रमण तत्वो की आयनिक त्रिज्वाएं भिन्न-भिन्न ऑक्सीकरण अवस्थाओ में भिन्न-भिन्न होती है। ऑक्सीकरण अवस्था का मान बढ़ने पर परमानवीय त्रिज्या का मान कम हो जाता है क्योकि नाभिकीय आवेश बढ़ जाता है । धनायन सदैव परमाणु से छोटे होते है।
प्रथम संक्रमण श्रेणी के द्विधनायनो की त्रिज्याएं परमाणु क्रमांक में वृद्धि पर घटती है।
आपनिक त्रिज्या ∝ 1/ऑक्सीकरण अवस्था
(5) गलनांक व क्वथनांक:- संक्रमण तत्वो में Zn वर्ग के तत्वो को छोड़कर अन्य तत्वो के गलनांक व क्वथनांक s-ब्लॉक के तत्वों की तुलना में बहुत उच्च होते हैं इसका कारण यह है कि इनके परमाणु परस्पर प्रबल बलों द्वारा जुड़े रहते हैं। ये प्रबल बल आंतरिक कोश मे अयुग्मित d – इलेक्ट्रॉनों द्वारा इनके परमाणुओ के बीच सहसंयोजक आबन्ध बनने के कारण होता है। अत: इनके गलनांक व क्वथनांक अयुग्मित d – इलेक्ट्रानो के बढ़ने से बढ़ते हैं।
(6) आयनन एन्थैल्पी:- संक्रमण तत्वो की आयनन एन्थैल्पी के मान s- ब्लाक के तत्वो से अधिक तथा p – ब्लाक तत्वो से कम होती है। प्रथम संक्रमण श्रेणी के तत्वो Sc से Zn तक इसका मान क्रमश बढ़ता है। [कुछ अपवादो को छोड़कर ]
(7) उत्प्रेरकीय गुण:- संक्रमण तत्वो का एक विशेष गुण इनकी एवं इनके यौगिको की उत्प्रेरकीय सक्रियता है जो इनमे d उपकोशो की उपस्थिति तथा परिवर्तनशील ऑक्सीकरण अवतथा प्रदर्शित करने के कारण होती है।
उत्प्रेरक की उपस्थिति में अभिकारको की संक्रियण ऊर्जा कम हो जाती है एवं क्रियाशीलता बढ़ जाती है जिसके कारण क्रिया शीघ्रता से सम्पन्न होती है।
प्रथम संक्रमण श्रेणी की कई धातुओ के अतिरिक्त अन्य तत्व जैसे- Mo, W, Pt व Pd का उपयोग भी उत्प्रेरक के रूप किया जाता है ।
कुछ अन्य अभिकर्मक:-
- (i) फेण्टान अभिकर्मक [ FeSO4 + H2O2]
- (ii) Fe व Mo
- (iii) जिगलर नाटा उत्प्रेरक
- (iv) समांगी उत्प्रेरक
- (v) विषमांगी उत्प्रेरक
8. चुम्बकीय गुणधर्म
(i) प्रति चुम्बकीय गुणधर्म:- कुछ पदार्थ बाह्य चुम्बकीय क्षेत्र मे रखे जाने पर उसकी तीव्रता को कम कर देते है एवं पदार्थ चुम्बकीय क्षेत्र से प्रतिकर्षित हो जाता है। ऐसे पदार्थ को प्रतिचुम्बकीय पदार्थ तथा इस को प्रति चुम्बकत्व कहते हैं। यह गुण अयुग्मित e– की अनुपस्थित में होता है।
(ii) अनुचुम्बकीय पदार्थ:- ऐसे पदार्थ जिन्हे बाह्य चुम्बकीय क्षेत्र में रखने पर क्षेत्र की तीव्रता को बढ़ा देते है तथा ये पदार्थ बाह्य क्षेत्र सें आकर्षित होते है, अनुचुम्बकीय पदार्थ कहलाते है।
यह गुण अयुग्मित e– की संख्या पर निर्भर करता है।
किसी परमाणु या आयन का कुल चुम्बकीय आपूर्ण (µ) उसके प्रतिचुम्बकीय (µd) और अनुचुम्बकीय (µp) आघूर्णो के योग के बराबर होता है।

चुम्बकीय आघूर्ण की गणना –
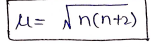
n = अयुग्मित e- की संख्या
(iii) लौह चुम्बकीय गुणधर्म:- जो पदार्थ चुम्बकीय क्षेत्र में अत्यधिक आकर्षित होते है, उन्हें लौह चुम्बकत्व पदार्थ कहते है और इस गुण को लौह चुम्बकत्व कहते है।
उदo → Fe, Co, Ni, Co, Ni, Fe3O4 और Mn
(9) संकुल (Complex) यौगिक का बनना:- संकुल यौगिक का बनना संक्रमण तत्वो की विशेषता है, जो कि रिक्त d- कक्षको की उपस्थिति के कारण होता है। ये तत्व बहुत अधिक संख्या में संकुल यौगिक बनाते हैं, जिन्हें उपसहसंयोजक यौगिक कहते है।
(10) मिश्रधातु का बनना:- दो या दो से अधिक धातुओ अथवा धातु व अधातु के समांगी विलयन को ठोस का मिश्रधातु कहते है।
संक्रमण धातुएं प्रायः मिश्र धातु बनाने का गुण रखती है। क्योंकि संक्रमण धातुओ के पारस्परिक परमणिवक आकार लगभग समान होते है। अत: ये तत्व क्रिस्टल जालको में परस्पर प्रतिस्थापन कर सकते हैं।
उदo → पीटल, कांसा, मुद्राधातु, गनमेटल आदि |
(11) परमाणवीय त्रिज्याएं :- संक्रमण तत्वो की परमाणवीय त्रिज्याएं s व p ब्लाक के तत्वो के मध्य होती है। किसी भी संक्रमण श्रेणी में बायी से दायी ओर जाने पर वर्ग 2 से वर्ग 10 तक तत्वो की त्रिज्याएं लगभग समान होती है और 3 से 7 वर्ग तक त्रिज्याएं धीरे-धीरे कम होती है और फिर वर्ग 12 तक त्रिज्या का मान बढ़ता है।
d ब्लाक तत्वो के कुछ प्रमुख यौगिक
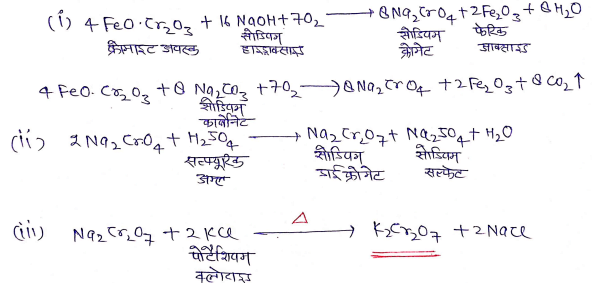
(i) पोटैशियम डाईक्रोमेट [k2Cr2 O7]
निर्माण की विधि – k2Cr2 O7 का निर्माण 3 स्टेप में होता है –
भौतिक गुण
- (i) यह नारंगी लाल क्रिस्टलीय ठोस है जो जल मे विलेय है, परन्तु ऐल्कोहॉल में अविलेय है |
- (11) इसका गलनांक 396°C होता है।
रासायनिक गुण
(1) ऊष्मा का प्रभाव

(2) ऑक्सीकारक गुण
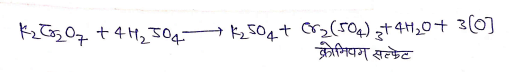
(a ) यह पोटैशियम आयोडाइड को आयोडीन में ऑक्सीकृत कर देता है।
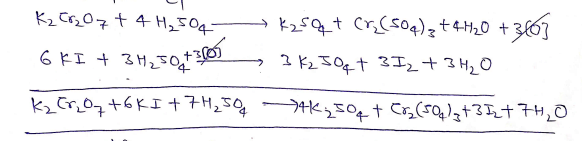
(b) यह हैलोजन अम्लो को हैलोजन में ऑक्सीकृत कर देता है।
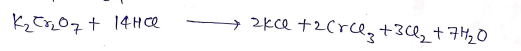
(C) यह सोडियम नाइट्रॉइड को नाइट्रेट में आक्सीकृत कर देता है।
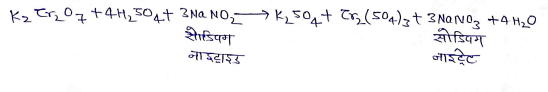
(3) अमोनियम क्लोराइड से क्रिया

(4) H2O2 से क्रिया :
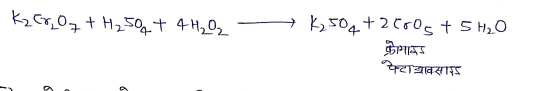
(5) क्रोमिल क्लोराइड परीक्षण :
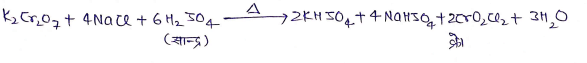
(6) पोटैशियम फेरोसायनाइड से क्रिया:
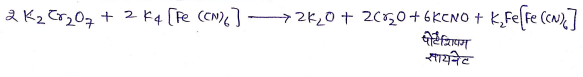
(7) कास्टिक क्षारो से क्रिया :
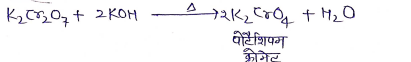
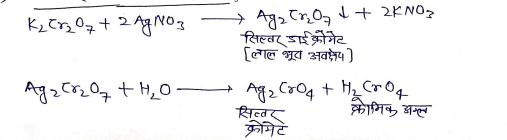
(8) सिल्वर नाइट्रेट से क्रिया :
उपयोग:
- (I) फेरस आयनो, I2 एवं सल्फाइड आयनो के मात्रक [आयतनगितीय] अनुमापन में।
- (II) चगड़ा उद्योग में क्रोम टेनिंग में।
- (III) प्रबल आवसीकारक के रूप में।
- (IV) फोटोग्राफी में जिलेटिन फिल्म के कठोरीकरण मे।
- (V) कैलिको छपाई एवं रंगाई में।
(ii) पोटैशियम परमैगनेट [KMnO4]
बनाने की विधि:-
(i) पाइरोलुसाइट का पोटैशियम मैग्नेट में परिवर्तन –
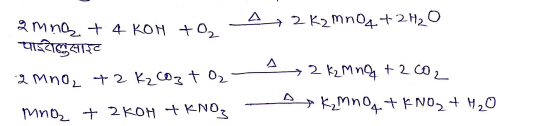
(ii) पोटैशियम मैग्नेट का पोटैशियम परमैग्नेट में परिवर्तन
(a) वैधुत अपघटनी ऑक्सीकरण –
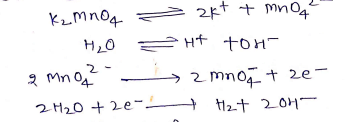
(b) रासायनिक ऑक्सीकरण –
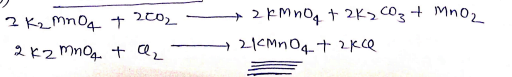
भौतिक गुण:-
- (i) यह एक बैगनी रंग का क्रिस्टलीय ठोस है।
- (ii) यह जल में विलेय है।
- (iii) इसका गलनांक 2500C है।
रासायनिक गुण:-
(1) ताप का प्रभाव:-
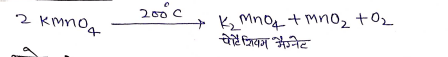
(ii) क्षारो से अभिक्रिया:-
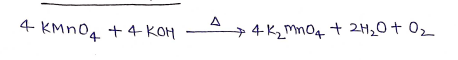
(iii) ठण्डे सान्द्र H2SO4 से अभिक्रिया
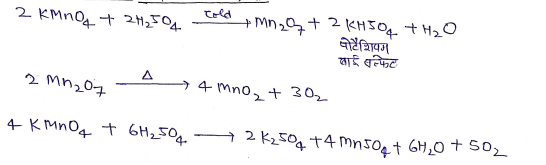
(iv) ऑक्सीकारक गुण.
(a) यह हाइड्रोजन परॉक्साइड को आक्सीजन में ऑक्सीकृत कर देता है।
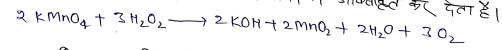
(b) यह आयोडाइड लवणो को आयोडेट लवणो में ऑक्सीकृत कर देता है।

(C) एल्कोहॉल को ऐल्डिहाइड में आक्सीकृत कर देता है।
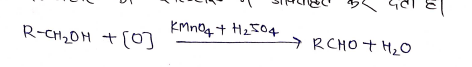
उपयोग:-
- (I) प्रयोगशाला तथा औद्योगिक ऑक्सीकारक के रूप में इसका उपयोग किया जाता है।
- (II) फेरस लवणो, ऑक्सेलेटो आदि के आयतनमापी विश्लेषण में इसका उपयोग किया जाता है ।
- (III) जल को शुद्ध करने में कीटनाशक [Disinfectant] के रूप में।
- (IV) बेपर अभिकर्मक के निर्माण मे जो कार्बनिक यौगिको की असंतृप्तता के परीक्षण में प्रयुक्त होता है।
- (V) आक्सीकारक के रूप में।
संरचना
![Class 12 Chemistry Chapter 8 Notes in Hindi d एवं f ब्लॉक के तत्व 24 (ii) पोटैशियम परमैगनेट [KMnO4]](https://readaxis.com/wp-content/uploads/2023/03/image-240.png)
f ब्लाक के तत्व (आन्तरिक संक्रमण तत्व)
- आवर्त सारणी मे अन्य प्रकार के संक्रमण तत्व भी होते है जो सामान्य संक्रमण तत्वो से भिन्न होते है तथा जिनके बाह्यतम तीन कोश आंशिक रूप से भरे होते है, इन्हे आन्तरिक संक्रमण तत्व कहते है।
- आन्तरिक संक्रमण तत्वो में अन्तिम e– (n-2)f उपकोश में प्रवेश करता है । इस कारण इनको f ब्लाक तत्व कहते है।
f – ब्लाक तत्वो की दो श्रेणियाँ होती है:-
(1). प्रथम आन्तरिक संक्रमण श्रेणी (लैन्थेनाइड या 4f श्रेणी):-
- इसमे सीरियम Ce (z=30) से ल्यूटीसियम Lu (z = 71) तक 14 तत्व होते है।
- इस श्रृंखला के सदस्यो को लैन्थेनाइट के अतिखित लैन्थेनॉन या दुर्लभ मृदा तत्वो के नाम से जाना जाता है।
- इस श्रेणी के तत्वो के गुण तृतीय संक्रमण श्रेणी के तत्व लेन्थेनम (La) से काफी समानता रखते है ।
(2) द्वितीय आन्तरिक संक्रमण श्रेणी [ ऐक्टिनाइड या 5f श्रेणी] :-
- इस श्रेणी में थोरियम Th (z=90) से लारो-सेयल Lr (z=103) तक के 14 तत्व होते है। इन तत्वो के भौतिक एवं रासायनिक गुण ऐक्टिनियम Ac (z= 89) से बहुत समानता रखते है। ये सभी तत्व रेडियो एक्टिव है।
- इनकी सामान्य आवसीकरण अवस्था 3 हैं।
[1] लैन्थेनाइडस (Lanthanides)
- (a) आवर्त सारणी में स्थान – इस श्रेणी में कुल 15 तत्व है लेकिन लैन्थेनम के बाद आने वाले 14 तत्वो [Ce से Lu तक) श्रेणी को लैन्थेनाइड श्रेणी तथा इन तत्वो को लेन्थेनाइड कहा जाता है।
- La को वर्ग 3 में Y के नीचे तथा अन्य चौदह तत्वो को आवर्त सारणी में नीचे अलग से स्थान दिया गया है।
- (b) इलेक्ट्रानिक विन्यास:- इनके अन्तिम e– 4f कक्षको में भरे जाते है। इन तत्वों का संयोजी इलेक्ट्रानिक विन्यास 4f1-14 5d0-1 6s2 लिखा जाता है।
लैन्थेनाइडो के सामान्य अभिलक्षण :
- (I) ये सभी सिल्वर जैसी सफेद एवं धातुऐ होती है, जो वायु में तुरन्त धुंधली हो जाती है अर्थात चमक खो देती है।
- (II) इनके प्रारम्भिक तत्व मुलायम होते है परन्तु परमाणु क्रमांक में वृद्धि के साथ इनकी कठोरता में वृद्धि होती हैं, जिनकी तनन सामर्थ्य कम होती है।
- (III) इनकी विशिष्ट धातु संरचना होती है, ये ऊष्मा तथा विद्युत की सुचालकता होती है।
- (IV) इन सभी तत्वो की कटी हुई सतह चमकदार होती है।
भौतिक गुणधर्म:-
- परमाणु एवं आयनिक त्रिज्याएं:- लैन्थेनाइडो का परमाणु क्रमांक जैसे-जैसे बढ़ता है, इनकी परमाणु त्रिज्याएं कम होती जाती है। लैन्थेनाइड मुख्यत +3 ऑक्सीकरण अवस्था दर्शाते है। इस ऑक्सीकरण अवस्था मे तत्वो के परमाणु क्रमांक बढ़ने के साथ-साथ आयनिक त्रिज्या का मान भी कम होता जाता है
- लैन्थेनाइड तत्वो मे बायी ओर से दायी ओर चलने पर परमाण्विक एवं आयनिक त्रिज्या का मान क्रमशः घटता है।
- आयनन एन्थैल्पी:- लैन्थेनाइड तत्वों की प्रथम आयनन एन्थैल्पी का मान लगभग स्थिर सा रहता है। इन तत्वो में आयनन एन्थैल्पी का मान लगभग 600 KJmol-1 के निकटतम होता है, जबकि द्वितीय आयनन एन्थैल्पी का मान 1200 KJmol-1 के लगभग होता है, जो लगभग Ca के समान है।
- रंग:- लैन्थेनाइडों का चांदी जैसा सफेद रंग होता है, परन्तु लैन्थेनाइड आयन ठोस व जलीय विलयन में रंगीन होते है।
- घनत्व:- इनके घनत्व उच्च होते है। इनके घनत्व सामान्यतः परमाणु क्रमांक वृद्धि के साथ-साथ बढ़ते है।
- गलनांक व क्वथनांक:- इनके गलनांक 1000 से 1200K के मध्य होते है लेकिन सेमेरियम (sm) 1623k पर पिघलता है |
- इनके परमाणु क्रमांक बढ़ने से गलनांक भी बढ़ते है केवल Eu व Er (अपवाद) को छोड़कर |
- ऑक्सीकरण अवस्था:- ये तत्व परिवर्ती ऑक्सीकरण अवस्था प्रदर्शित करते है। इन तत्वो की सामान्य ऑक्सीकरण अवस्था +3 होती है। इसके अतिरिक्त कुछ तत्व +2 व +4 ऑक्सीकरण अवस्था भी प्रदर्शित करते हैं।
- चुम्बकीय गुण:- लगभग सभी तत्व आयन अनुचुम्बकीय गुण व्यक्त करते हैं।
रासायनिक गुणधर्म:- सामान्यतः लैन्थेनाइड d ब्लाक तत्वो से अधिक क्रियाशील होते है।
(i) कार्बन से अभिक्रिया
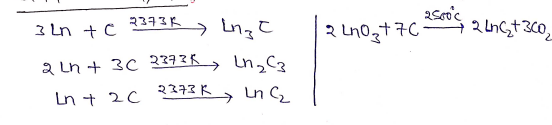
(ii) ऑक्सीजन व सल्फर से अभिक्रिया:-
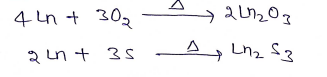
(iii) जल से अभिक्रिया:- ये ठण्डे जल से क्रिया करके H2 गैस मुक्त करते है।

(iv) हैलोजन, हाइड्रोजन, नाइट्रोजन से क्रिया
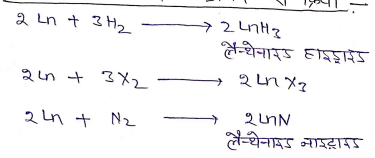
लैन्थेनाइड संकुचन
लैन्थेनाइड श्रेणी में बाँये से दांये ओर जाने पर परमाणु आकार तथा आयनिक त्रिज्या दोनो में लगातार कमी होती है जोकि 4f है उपकोश मे नया e– के प्रवेश के कारण होता है जब तक 4f – उपकोश में नया e– प्रवेश करता रहता है , तक तब तक परमाणु या आयन का आकार घटता रहता है , इसे लैन्थेनाइड संकुचन कहते है।
लैन्थेनाइड संकुचन के प्रभाव:
- (i) यट्रियम (Y) की भारी लैथेनाइडो से समानता।
- (ii) लैन्थेनाइडो के गुणो में बहुत अधिक समानता।
लैन्थेनाइड संकुचन के परिणाम –
- लैन्थेनाइड संकुचन के कारण इनके रासायनिक गुणो में काफी समानता होती है जिसके कारण आयन विनियम विधि द्वारा पृथक्करण किया जाता है।
- लेन्थेनम के आगे प्रत्येक तत्व की परमाणु त्रिज्या समूह के ऊपर रखे तत्व की परमाणु त्रिज्या के समान होती है।
- लैन्थेनाइडों के ऑक्साइडो तथा हाइड्राक्साइडो के क्षारीय प्रबलता में क्रमश: कमी होती है।
कारण:- लैन्थेनाइडों आकार में कमी होने के कारण सहसंयोजी लक्षण बढ़ते है जिससे क्षारीय प्रबलता घटती है। La(OH) 3 अत्यधिक क्षारीय है जबकि Lu(OH)3 कम क्षारीय है। इसी प्रकार ऑक्साइडो की क्षारीयता भी La से Lu घटती है।
लैन्थेनाइडो के उपयोग :
- ये तत्व विभिन्न कार्बनिक यौगिको के हाइड्रोजनीकरण विहाइड्रोजनीकरण ऑक्सीकरण आदि रासायनिक अभिक्रियाओ मे उत्प्रेरक के रूप में।
- Nd और Pr के ऑक्साइड Nd2O3 व Pr2O3 का उपयोग रंगीन कांच बनाने में किया जाता है।
- सीरियम (Ce) ताप तथा पराबैगनी प्रकाश दोनो का अवशोषण करता है। अत: इसका उपयोग चश्मे बनाने में किया जाता है।
- पेट्रोलियम पदार्थो के भंजन के लिए फॉस्फेट का उपयोग किया जाता है।
ऐक्टिनाइड्स [Actinides] :-
वे तत्व जिनके अन्तिम इलेक्ट्रॉन 5f श्रेणी में प्रवेश करते हैं, ऐक्टिनाइड कहलाते है। ऐक्टिनाइड को एंक्टिनान भी कहा जाता है। इसमें थोरियम Th (90) और लॉरेन्सियम Lr(103) तक के चौदह तत्व होते है।
इलेक्ट्रानिक विन्यास – इनका सामान्य इलेक्ट्रानिक विन्यास 5f1-14 6d0-1 7s2 होते है।
ऐक्टिनाइड्स के सामान्य लक्षण :-
- इनकी विद्युत धनात्मकता उच्च होती है।
- इनके गलनांक व क्वथनांक उच्च होते है, परन्तु संक्रमण तत्वो की अपेक्षा कम होते हैं।
- ये चांदी के समान सफेद धातुएं होती है, परंतु विभिन्न प्रकार की संरचनावे दर्शाती है।
- थोरियम तथा ऐगोरिशियम के अतिरिक्तत शेष सभी के घनत्व अन्य ऐविटनाइड्स के घनत्व से के घनल से उच्च होते जो पहले पहले बढ़ते है और फिर घटते है।
- इनमें रंगीन तत्व पाये जाते हैं। [Ac को छोड़कर)
- ये सभी रेडियोधर्मी है।
- ये 5f उपकोश गें अयुग्गित e– की उपस्थिति के कारण अनुचुम्बकीय होते हैं। [Ac+3, Th+4, Lr+3 को छोड़कर]
- ये उबलते जल से क्रिया करके हाइड्राक्साइड एवं आवसाइड बनाते है।
- ये क्षारो के साथ कोई क्रिया नहीं करते है
- ये सभी अत्यधिक क्रियाशील धातुएँ है अत: ये प्रबल अपचायक है तथा अधातुओ से क्रिया करके संगत यौगिक बनाते है।
- ये संकर यौगिक बनाते है।
ऐक्टिनाइड संकुचन:- ऐक्टिनाइड श्रेणी में बांये से दांये ओर जाने पर परमाणु आकार तथा आयनिक त्रिज्या दोनो में लगातार कमी होती है जोकि 5f उपकोश नये e– के प्रवेश के कारण होता है जब तक 5f उपकोश में नया e– प्रवेश करता है, तब तक परमाणु या आयन का आकार घटता रहता है। इसे ही ऐक्टिनाइड संकुचन कहते है।
उपयोग :-
- आजकल थोरियम लवण का उपयोग कैंसर के उपचार में होता है।
- थोरियम आवसाइड का उपयोग परमाणु हथियार बनाने में होता है।
- यूरेनियम के लवणों का उपयोग हरे रंग के कांच के निर्माण में होता है।
- यूरेनियम लवणों का उपयोग सिरेमिक उद्योग, टेक्साटाइल उद्योग रासायनिक विश्लेषण तथा औषधियों में होता है।
Chapter 1 – ठोस अवस्था
Chapter 2 – विलयन
Chapter 3 – वैधुतरसायन
Chapter 4 – रसायनिक बलगतिकी
Chapter 5 – पृष्ठ रसायन
Chapter 6 – तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम
Chapter 7 – P- ब्लॉक के तत्त्व
Tagged with: Chemistry chapter 8 class 12 notes in hindi | Chemistry class 12 chapter 8 in hindi notes | Chemistry class 12 chapter 8 notes in hindi | class 12 Chemistry chapter 8 ncert notes in hindi | Class 12 Chemistry Chapter 8 Notes in Hindi | d and f block elements notes in hindi
Aldihaed,kiton,
No
D and f block