Class 12 Chemistry Chapter 3 Notes in Hindi
वैधुत रसायन परिभाषा
रसायन विज्ञान की वह शाखा जिसके अन्तर्गत रासायनिक ऊर्जा को विद्युत ऊर्जा में तथा विद्युत ऊर्जा को रासायनिक ऊर्जा मे तथा उसमें होने वाले परिवर्तनों का अध्ययन किया जाता है उसे वैद्युत रसायन कहते हैं ।
सेल(Cell)
जिस पात्र में विद्युत ऊर्जा एवं रासायनिक ऊर्जा में परिवर्तन कराते है उसे सेल कहते हैं। यह दो प्रकार का होता है-
- वैद्युत रासायनिक सेल (Electrochemical cell) – वे सेल जो रासायनिक ऊर्जा को विद्युत ऊर्जा में बदलते हैं उसे विद्युत रासायनिक सेल कहते हैं। जैसे:- गैल्वेनिक सेल, वोल्टीय सेल। इस सेल की खोज गैल्वेनी तथा वोल्टा नामक वैज्ञानिक ने की थी इसीलिए इसे सेल को गैल्वेनिक तथा वोल्टीय सेल कहते हैं ।
- विद्युत अपघटनी सेल (Electrolytic cell) – वे सेल जो विद्युत ऊर्जा को रासायनिक ऊर्जा में बदलते हैं, उसे विद्युत अपघटनी सेल कहते है
गैल्वैनी सेल
सर्वप्रथम इस सेल का निर्माण सन् 1780 में लुइजी गैल्वेनी तथा सन् 1800 में एलेसैण्ड्रो वोल्टा द्वारा किया गया था। अतः इसे गैल्वेनिक सेल या वोल्टीय सेल कहते है।
इन सेलो से रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित किया जाता है। इस सेल की कार्य प्रणाली रेडॉक्स अभिक्रिया पर आधारित है। इसमें ऑक्सीकरण तथा अपचयन की अभिक्रिया अप्रत्यक्ष रूप से भिन्न-भिन्न पात्रो में होती है जो लवण सेतु से आपस में जुड़े होते है।
इलेक्ट्रोड विभव का मापन
किसी इलेक्ट्रोड की इलेक्ट्रॉन त्यागने अथवा ग्रहण करने की प्रवृत्ति उसका इलेक्ट्रोड विभव कहलाती है। इसे E° के द्वारा प्रदर्शित करते हैं तथा इसे वोल्ट में मापा जाता है।
यह निम्न कारकों पर निर्भर करता है-
- धातु की प्रकृति पर ।
- विलयन में उपस्थित धातु आपन की सान्द्रता पर।
- तापमान पर।
नेर्नस्ट समीकरण
किसी इलेक्ट्रोड का विभव उसके आयन की विलयन की सान्द्रता तथा ताप पर निर्भर करता है जिसके मध्य संबंध दर्शाने वाले समीकरण को नर्नस्ट समीकरण कहते हैं।
नेर्नस्ट समीकरण का फॉर्मूला

E = सेल का अभिक्रिया विभव
E°= सेल का मानक विभव
R = गैस स्थिरांक
F = फैराडे स्थिरांक
T = केल्विन में ताप क्रम
n = आयन का चार्ज
Q = Reaction quoteint
नेर्नस्ट समीकरण से साम्य स्थिरांक
यह अभिक्रिया समय के साथ साथ साम्यावस्था की तरफ गति करती जाती है, समय के साथ अभिकारक की मात्रा कम होती जाती है तथा उत्पाद की मात्रा बढती जाती है , एक स्थिति ऐसी आती है जब यह अभिक्रिया साम्यावस्था में पहुच जाती है , जब यह अभिक्रिया साम्यावस्था प्राप्त कर लेती है उस स्थिति में सेल का विभव शून्य हो जाता है अर्थात साम्यावस्था में Eसेल = 0 हो जाता है।
किसी सेल की अभिक्रिया निम्न है –
aA + bB → cC + dD
सेल की अभिक्रिया के लिए नेर्न्स्ट समीकरण निम्न प्रकार लिखा जा सकता है –
Eसेल = E०सेल – (0.59 / n){log([C]c[D]d) / ([A]a[B]b)
यदि ([C]c[D]d) / ([A]a[B]b) = Kc है
Kc = साम्य स्थिरांक है
दोनों मानो को नेर्न्स्ट समीकरण में रखने पर –
0 = E०सेल – (0.59/n){logKc}
E०सेल = (0.59/n){logKc}
logKc = nE०सेल/0.59 ।
विधुतरासायनिक सेल अभिक्रिया का गिब्ज उर्जा
गिब्स एनर्जी, जिसे गिब्स फंक्शन के रूप में भी पहचाना जाता है, एक मात्रा है जिसका उपयोग निरंतर तापमान और दबाव के साथ थर्मोडायनामिक सिस्टम में किए गए काम की अधिकतम मात्रा की गणना करने के लिए किया जाता है गिब्ज ऊर्जा कहलाता है।
इसमें G गिब्स की मुक्त ऊर्जा का प्रतिनिधित्व करता है, और इसे जूल या किलोजूल में मापा जाता है। यह एक बंद प्रणाली से निकाले गए कार्य की अधिकतम मात्रा को गिब्स की मुक्त ऊर्जा के रूप में परिभाषित किया गया है।
विधुतरासायनिक सेल अभिक्रिया का गिब्ज उर्जा =

∆rG° = अभिक्रिया की मानक गिब्ज ऊर्जा
E° = सेल का मानक विभव
F = फैराडे स्थिरांक
n = आयन का चार्ज
Ohm’s Law (ओम का नियम)
चालक के सिरों पर आरोपित विभवांतर इसमें बहने वाली विद्युत धारा के समानुपाती होती है।
प्रतिरोध – किसी चालक में विद्युत धारा अवरोध को प्रतिरोध कहते है।
विशिष्ट प्रतिरोध: 1C.M3 वाले किसी चालक का प्रतिरोध उसकी विशिष्ट प्रतिरोध होता है।
विशिष्ट चालकता: किसी चालक की विशिष्ट चालकता उसके विशिष्ट प्रतिरोध का व्युत्क्रम होता है।
चालकता:- किसी चालक के प्रतिरोध का व्युत्क्रम चालकता कहलाती है।
आयनिक विलयनों की चालकता का मापन
किसी धात्विक तार के प्रतिरोध के मापन में DC विद्युत आपूर्ति का उपयोग किया जाता है। यदि चालकता सेल के माध्यम से DC करंट लगाते हैं, तो यह सेल में लिए गए घोल के इलेक्ट्रोलिसिस को बढ़ावा देगा। तो, इलेक्ट्रोलिसिस को रोकने के लिए इस माप के लिए एसी करंट का उपयोग किया जाता है।
परिवर्ती प्रतिरोध ‘S’ को तब तक समायोजित किया जाता है जब तक कि ब्रिज संतुलित न हो जाए, इस स्थिति में संसूचक से कोई धारा प्रवाहित न हो।

सांद्रता के साथ चलकता एवं मोलर चलकता में परिवर्तन
मोलर चालकता – स्थिर ताप एवं निश्चित सांद्रण पर एक मोल विद्युत अपघट्य के विलयन की चालकता मोलर चालकता कहते है।
अथवा किसी विद्युत अपघट्य के आविक चालकता उसकी विशिष्ट चालकता k तथा आयतन v का गुणनफल होता है जिसमे विद्युत अपघट्य का एक-ग्राम मोल घुला हो।
- सान्द्रता का प्रभाव :– सांद्रता बढ़ाने अथवा कम करने पर मोलर चालकता में वृद्धि होती है ।
तुल्यांकी चालकता – एक ग्राम तुल्यांक विद्युत अपघट्य के विलयन की चालकता उसकी तुल्यांकी चालकता कहते हैं।
विद्युत्अपघटय
प्रबल विद्युत्अपघटय :-
वे विद्युत अपघट्य जो प्रत्येक तनुता पर पूर्णतया आयनित होते हैं जिससे इन विलयनों की आयनों की संख्या अधिकतम होती है। इसके विलयन की चालकता उच्च होती है। उदा. NaCl, KCl, NaOH, CH3CooNa
दुर्बल वविद्युतअपघटय:- वे विद्युत अपघट्य जो विलयनों में आशिक रूप से वियोजित होते हैं। ये कम मात्रा में वियोजित होने के कारण इनके विलयनों में आयनों की संख्या कम होती है जिससे इनकी चालकता कम होती है
उदाहरण के लिए– HCOOH (फार्मिक अम्ल), अमोनियम ऐसीटेट, आदि।
वैधुतअपघटनी सेल एवं विधुतअपघटन
विद्युत अपघटनी सेल :- जिस सेल में विद्युत अपघटन होता है उसे विद्युत अपघटनी सेल कहते है।
इस सेल में धातु की दो प्लेटें या तार डुबा दिए जाते हैं, जिन्हें इलेक्ट्रोड कहते हैं। इलेक्ट्रोड दो प्रकार के होते हैं।
- एनोड:- वह इलेक्ट्रोड जहाँ पर ऑक्सीकरण होता है एनोड कहलाता हैं।
- कैथोड:- वह इलेक्ट्रोड जिस पर अपचयन होता है कैथोड कहलाता है। यहाँ पर इलेक्ट्रॉन ग्रहण किए जाते हैं
विधुतअपघटन :-विद्युत अपघट्य में विद्युत धारा प्रवाहित करते हैं (पिघली अवस्था या जलीय विलयन) तो वह अलग हो जाती है, जिसे विद्युत अपघटन कहते हैं
बैटरियां
दो या दो से अधिक सेलों का समूह जिन्हें श्रेणीक्रम में जोड़कर उनसे विद्युत धारा प्राप्त की जाती है, बैटरी कहलाते हैं
प्राथमिक बैटरी
वे सेल जिसे पुन आवेशित नहीं किया जा सकता है तथा एक ही बार उपयोग होता है। जब तक रेडॉक्स अभिक्रिया होती रह है तब तक कार्य करते हैं। इसमें अभिक्रिया केवल एक ही दिशा में सम्पन्न होती है। अभिक्रिया के पूर्ण हो जाने पर सेल अनुपयोग हो जाते है।
एक व्यापारिक सेल या बैटरी में निम्न गुण होने चाहिए:
- (i) ये भार में कम तथा छोटा
- (ii) स्थिर वोल्टेज
- (iii) पुन: आवेशित
- (iv) कम कीमत

संचारक बैटरी
वे सेल जिन्हें विद्युत धारा प्रवाहित करके पुनः आवेशित कर बार-बार उपयोग में लाया जा सकता है।

ईंधन सेल
वे सेल जिनमें H2, CH4 आदि जैसे ईंधनों के दहन से प्राप्त ऊर्जा को सीधे विद्युत ऊर्जा में परिवर्तित किया जाता है, ईंधन सेल कहलाते है।
ईंधन सेल की विशेषताएँ :-
- प्रदूषण राहित कार्यप्रणाली- ईंधन सेलों में किसी भी प्रकार का हानिकारक उत्पाद नहीं बनता है।
- उच्च दक्षता- ईंधन सेलो की दक्षता लगभग 70-751 जो कि अन्य परम्परागत सेलों से बहुत ज्यादा है।
- ऊर्जा के सतत् स्रोत- ये लगातार विद्युत ऊर्जा उत्पन्न करने वाले स्रोत होते है।
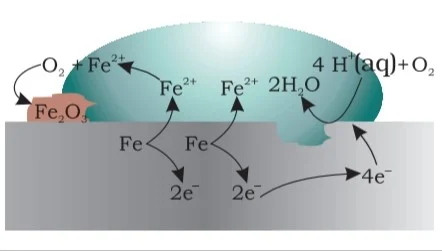
संक्षारण

संक्षारण एक विद्युत रासायनिक घटना है, जिसमें धातु वायुमण्डल की नमी एवं ऑक्सीजन से क्रिया करके धीरे-धीरे अवाद्धनीय यौगिक में परिवर्तित होती जाती है। धातुओं के इस तरह नष्ट होने की प्रक्रिया को संक्षारण कहते है।
संक्षारण के कारण पुलों, भवनों, जहाजों तथा लोहे से बनी अन्य वस्तुओं को बहुत हानि होती है
उदाहरण:
(i) लोहे पर जंग लगना।
(ii) चादी का काला पड़ना।
इसे भी पढे – Class 12 Chemistry Chapter 1 Notes in Hindi ठोस अवस्था
Tagged with: Chemistry chapter 3 class 12 notes in hindi | Chemistry class 12 chapter 3 in hindi notes | Chemistry class 12 chapter 3 notes in hindi | class 12 Chemistry chapter 3 ncert notes in hindi | Class 12 Chemistry Chapter 3 Notes in Hindi
I need biology Hindi all chapter notes in pdf form..
you can download pdf from here:- https://readaxis.com/class-12-biology-handwritten-notes-in-hindi-pdf-download/
Que. Ans. pdf send kar do ji
Thos kya hai