Here We have provided Class 12 Chemistry Chapter 4 Notes in Hindi. Class 12 Chemistry Chapter 4 Notes in Hindi will help you in understanding the chapter better & will be helpful in your exam preparation.
Class 12 Chemistry Chapter 4 Notes in Hindi
रसायनिक बलगतिकी
रसायन विज्ञान की वह शाखा जिसके अंतर्गत अभिक्रिया की दर एवं क्रियाविधि का अध्ययन किया जाता है, रासायनिक बलगतिकी कहलाता है।
अभिक्रियाओं के अध्ययन से संबंधित निम्न पाँच मुख्य बिन्दु हैं –
- किसी रासायनिक अभिक्रिया की सम्भाव्यता :- रासायनिक ऊष्मागतिकी के अनुसार मुक्त ऊर्जा में परिवर्तन (∆G) ऋणात्मक होने पर रासायनिक अभिक्रिया होती है अर्थात
- ∆G=-Ve (रासायनिक अभिक्रिया होगी)
- ∆G = +ve (रासायनिक अभिक्रिया नहीं होगी)
- ∆G= 0 ( रासायनिक अभिक्रिया साम्यावस्था में होगी)
- अभिक्रिया कितनी मात्रा में आगे बढ़ेगी या पूर्ण होगी जो कि रासायनिक साम्य से निर्धारित होती है।
- अभिक्रिया की गति (दर) या साम्य स्थापित होने में लगा समय |
- गति (दर) को प्रभावित करने वाले कारक।
- अभिक्रिया की क्रियाविधि या अंतिम उत्पाद प्राप्त करने में प्रयुक्त चरण।
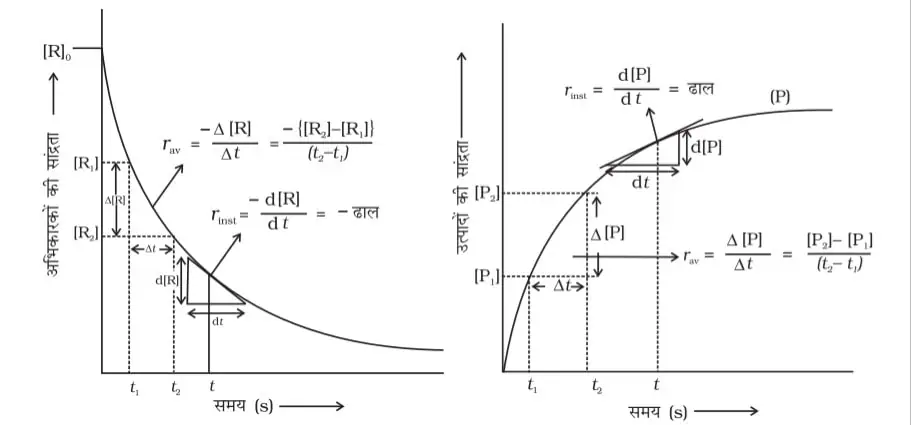
रसायनिक अभिक्रिया वेग
इकाई समयान्तराल में अभिकारक या उत्पाद की मोलर सान्द्रता मे परिवर्तन को रासायनिक अभिक्रिया की दर कहते है।
अभिक्रिया में सांद्रता की परिर्वतन में लगा समय
∆t = t2 – t1
क्रियाकारक की सांद्रता
∆[R] = [R]2 – [R]1
उत्पाद की सांद्रता
∆[P] = [P]2 – [P]1
P= उत्पाद
R = अभिकारक
T= समय
अभिक्रिया वेग को प्रभावित करने वाले कारक
अभिक्रिया की दर को प्रभावित करने वाले कारक :-
अभिकारक का सान्द्रण:- अभिकारकों की सान्द्रता बढ़ने से अभिक्रिया की दर भी बढ जाती है। कारण पदार्थ की मात्रा अधिक होती है।
ताप का प्रभाव:- सामान्यतः अभिक्रिया की दर ताप में वृद्धि के साथ बढ़ती है।
- ऊष्माक्षेपी अभिक्रिया में अभिक्रिया दर, ताप वृद्धि के साथ घट जाती है।
- ऊष्माशोषी अभिक्रियाओं में अभिक्रिया दर, ताप वृद्धि के साथ बढ़ जाती है।
प्रति 10°c ताप बढ़ाने पर अभिक्रिया लदर लगभग दुगुनी हो जाती है।
अभिकारकों का क्षेत्रफल:- छोटे आकार वाले कण, बड़े आकार वाले कणों की तुलना में अधिक तीव्रता से अभिक्रिया करते हैं।
विषमांग अभिक्रियाओं तुलना में समांग अभिक्रिया तेजी से उत्पन्न होती है।
अभिकारकों की रासायनिक प्रकृति:- रासायनिक अभिक्रिया में अभिकारकों के बंध टूटते हैं तथा उत्पादों के बन्ध बनते हैं। बन्ध की प्रकृति व सक्रियण ऊर्जा में अन्तर होने से अभिक्रिया की दर प्रभावित होती हैं।
विकिरण का प्रभाव:- अभिकारक तंत्र द्वारा उपयुक्त विकिरणों के फोटॉनों के अवशोषण के कुछ रासायनिक अभिक्रिया की दर तीव्र हो जाती है। इन अभिक्रियाओं को प्रकाश रासायनिक अभिक्रिया कहते हैं।
उत्प्रेरक का प्रभाव:- उत्प्रेरक, अभिक्रिया की सक्रियण ऊर्जा को कम कर देते हैं तथा अभिक्रिया सम्पन्न होने के लिए एक नया पथ उपलब्ध करा देते हैं।
दाब का प्रभाव:- गैसीय अभिक्रियाओं में दाब बढ़ाने पर अभिक्रिया की दर बढ़ जाती है।
अभिक्रिया की कोटि
किसी अभिक्रिया की कोटि उन समस्त घातो का योग है, जिन्हें अभिक्रिया की प्रेक्षित दर दर्शाने के लिए दर-नियम समीकरण में सान्द्रण पदों पर लगाया जाना चाहिए।
Reaction- aA + bB +cC = product
अभिक्रिया की दर – r ∝ [A]a[B]b[C]c
r=k[A]a[B]b[C]c
अभिक्रिया की कोटि (n) = a+b+c
अभिक्रिया की कोटि कोटि शून्य, पूर्णांक, अपूर्णांक, धनात्मक, ऋणात्मक हो सकता हैं।
अभिक्रिया की आणविकता
किसी क्रिया की अणुसंख्यता से तात्पर्य अभिक्रिया में क्रिया करने वाले उन अणुओं की संख्या से है जो आपस में टक्कर करके रासायनिक क्रिया या परिवर्तन कराते हैं।
N2 + 3H2 → 2NH3 यहाँ m=4
समाकित वेग समीकरण
शुन्य कोटि की अभिक्रियाएं
यदि किसी अभिक्रिया का वेग (दर) अभिकारको की सांद्रता पर निर्भर नहीं करता है तो उसे शून्य कोटि अभिक्रिया कहते है।

शून्य कोटि अभिक्रिया की इकाई
K = मोल1 – (a+b)
लीटर (a+b) – 1 सेकण्ड-1K = मोल1 – (0) लीटर(0) (a+b)
प्रथम कोटि की अभिक्रिया
वे रासायनिक अभिक्रियाएँ जिनमें अभिक्रिया की दर अभिकारक पदार्थ की सान्द्रता की प्रथम घात के समानुपाती होता है, प्रथम कोटि अभिक्रिया ( first order reaction ) कहलाती है |
A → उत्पाद
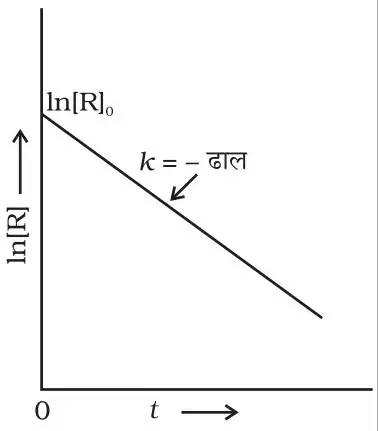
यदि किसी अभिकारक पदार्थ की प्रारम्भिक सान्द्रता मोल है तथा t sec पश्चात् इसके x mole वियोजित हो जाते है तब प्रथम कोटि की अभिक्रिया के लिए ,
Dx/dt ∝ [A] ¹
Dx/dt = k [A]¹
जहाँ , k = प्रथम कोटि अभिक्रिया के लिए वेग स्थिरांक
Dx/dt = k ( a – x )
Dx/( a -x) = k dt
अभिक्रिया की अर्धायु
वह समय जिसके अन्तर्गत अभिकारक की सान्द्रता उसकी प्रारंभिक सान्द्रता की आधी रह जाती है।
शुन्य कोटि की अभिक्रिया के लिए अर्द्ध आयु सूत्र

प्रथम कोटि की अभिक्रिया के लिए अर्द्ध आयु सूत्र

आर्रेनिअस का टक्करो का सिद्धान्त
- जब अभिकारक की अणुएँ आपस में टकराती हैं तभी अभिक्रिया होती है।
- अणुओं का उपयुक्त दिशा में टकराना आवश्यक है।
- अभिक्रिया समपन्न होने के लिए अणुओं के पास इतनी ऊर्जा होनी चाहिए ताकि वह सक्रियित संकुल बना सके
- अभिकारक के अणु परस्पर टकराकर सक्रियित संकुल में तब तक परिवर्तित नहीं हो सकते जब तक कि वह इतनी ऊर्जा वाले न हो की ऊर्जा अवरोध को पार करके उत्पाद में परिवर्तित हो सके।
देहली ऊर्जा (Threshold Energy):- अभिक्रिया सम्पन्न करने के लिए अणु में उपस्थित न्यूनतम ऊर्जा को देहली ऊर्जा कहते हैं
सक्रियण ऊर्जा (Activation energy):- सक्रियण ऊर्जा ऊर्जा की वह न्यूनतम मात्रा है जो देहली ऊर्जा से कम ऊर्जा वाले अणुओं को प्राप्त करनी पड़ती है जिससे ऊर्जा अवरोध को पार कर सके।
सक्रियण ऊर्जा = देहली ऊर्जा -अभिकारक में कुल ऊर्जा
ऊर्जा अवरोध (Energy barrier):- ऊर्जा अवरोध वह न्यूनतमा ऊर्जा है जिसे पार करने के बाद ही अभिकारक उत्पाद में परिवर्तित हो सकती है, ऊर्जा अवरोध कहलाता है।
ऊष्मा क्षेपी अभिक्रिया (Exothermic reaction):- जिन अभिक्रिया में उत्पाद निर्माण के साथ ऊष्मा का भी उत्सर्जन होता है, ऊष्माक्षेपी अभिक्रियाएँ कहलाती हैं।
ऊष्माशोषी अभिक्रिया (Endothermic reaction):- जिन अभिक्रियाओं में ऊष्मा का अवशोषण होता है, उन्हें ऊष्माशोषी अभिक्रिया कहते हैं।
आर्रेनिअस समीकरण:- आर्रेनिअस समीकरण के अनुसार अभिक्रिया का वेग स्थिरांक e-Ea/RT के समानुपाती होता है।
log10k = log10A -Ea/RT(2.303)
यदि ताप को T1 से T2 करने pr दर स्थिरांक K1 से K2 हो जाएगा तब आर्रेनिअस समीकरण

More Resources:
Class 12 Chemistry Chapter 3 Notes in Hindi वैधुतरसायन
Class 12 Chemistry Chapter 2 Notes in Hindi विलयन
Class 12 Chemistry Chapter 1 Notes in Hindi ठोस अवस्था
We hope Class 12 Chemistry Chapter 4 Notes in Hindi will help you. If you have any questions regarding Class 12 Chemistry Chapter 4 Notes in Hindi feel free to ask in the comment section.
Tagged with: Chemical Kinetics notes in hindi | Chemistry chapter 4 class 12 notes in hindi | Chemistry class 12 chapter 4 in hindi notes | Chemistry class 12 chapter 4 notes in hindi | class 12 Chemistry chapter 4 ncert notes in hindi | Class 12 Chemistry Chapter 4 Notes in Hindi PDF Download
handwritten notes nhi dikha rha hai,
or download bhi nhi ho rha hai.
chemestry 12th
Ab check kijiye