Here We have provided Class 12 Chemistry Chapter 5 Notes in Hindi. Class 12 Chemistry Chapter 5 Notes in Hindi will help you in understanding the chapter better & will be helpful in your exam preparation.
Class 12 Chemistry Chapter 5 Notes in Hindi पृष्ठ रसायन
पृष्ठ रसायन
रसायन विज्ञान की वह शाखा जिसके अन्तर्गत ठोस या द्रव के सतह पर होने वाले भौतिक एवं रासायनिक घटनाओं का अध्ययन किया जाता है। जैसे- घुलना, क्रिस्टलीकरण, संक्षारण, इलेक्ट्रोड की प्रक्रियाएँ, उत्प्रेरक, उत्प्रेरण, अधिशोषण, कोलॉइड ।
अधिशोषण: किसी ठोस या द्रव की सतह पर किसी पदार्थ के अणुओं को आकर्षित कर जुड़ने की प्रक्रिया अधिशोषण कहलाती है। जिसके फलस्वरूप सतह पर अणुओं का साद्रण अधिक हो जाता है।
अवशोषण (Absorption): किसी ठोस या द्रव की सतह और उसके अन्दर तक किसी पदार्थ के अणुओं को आकर्षित कर जुड़ने की प्रक्रिया अवशोषण कहलाती है।
अधिशोषक(Adsorbent): वह पदार्थ जिसकी सतह पर अधिशोषण की घटना होती है, अधिशोषक कहलाता है।
अधिशोष्य(Adsorbate): वह पदार्थ जो ठोस या द्रव की सतह पर आकर्षित होता है, अधिशोष्य कहलाता है।
अधिशोषण एवं अवशोषण में विभेद
| अधिशोषण | अवशोषण |
|---|---|
| यह एक पृष्ठीय घटना है | यह पूरे माध्यम की घटना है। |
| यह प्रारंभ में तीव्र प्रक्रिया है तथा बाद में धीमी हो जाती है। साम्य स्थापित हो जाता है | इसमें पूरी प्रक्रिया में गति एकसमान होती है। |
| अधिशोषित पदार्थ का साद्रण,अन्दर माध्यम की तुलना मे बाह्य सतह पर अधिक होता हैं। | इसके बाह्य व अन्दर दोनों सतहों में सान्द्रण समान रहता है। |
| अधिशोषक की सतह से अधिशोषित पदार्थ को हटाया जा सकता है। | अवशोषण में पृथक्करण विशिष्ट विधियों द्वारा सम्पन्न होता है जैसे वाष्पन, क्रिस्टलीकरण आदि । |
अधिशोषण की क्रियाविधि
अधिशोषण एक ऊष्माक्षेपी अभिक्रिया है क्योंकि अधिशोषण की प्रक्रियाओं में जब अधिशोषण होता है तब अधिशोषक अधिशोष्य की अणुओं को जोड़ती है तब नया बन्ध बनाता (वाण्डरवॉल्स है जिसके कारण ऊष्मा मुक्त होती है अत: यह ऊष्माछेपी अभिक्रिया है।
अधिशोषण के प्रकार
अधिशोषण दो प्रकार के होते हैं जो निम्नलिखित है :-
1. भौतिक अधिशोषण (Physisorption):- इस प्रकार के अधिशोषण- में अधिशोषक पदार्थ और अधिशोष्य पदार्थ की अणु दुर्बल आकर्षण बल से जुड़े होते हैं। इन दुर्बल बलो को वाण्डर वॉल बल कहते हैं।
भौतिक अधिशोषण अस्थायी प्रकृति का होता है। ताप को बढाकर या गैस के दाब को कम करके अधिशोषण की मात्रा कम की जा सकती है। जैसे- चारकोल की सतह पर गैसों का अधिशोषण।
2.रसायनिक अधिशोषण :- इस प्रकार के अधिशोषण में अधिशोषक पदार्थ और अधिशोषक पदार्थ की अणुएँ प्रबल रासायनिक बन्ध से जुड़ी होती हैं। भौतिक अधिशोष तुलना में रासायनिक अधिशोषण का स्थायित्व अधिक होता है।
भौतिक अधिशोषण एवं रासायनिक अधिशोषण में अन्तर
| भौतिक अधिशोषण | रासायनिक अधिशोषण |
|---|---|
| यह विशिष्ट प्रकृति प्रदर्शित नहीं करता है। | यह अत्यन्त विशिष्ट प्रकृति का होता है। |
| आसानी से द्रव में परिवर्तित होने वाली गैसों को आसानी से अधिशोषित होती है। | यह गैस की द्रव प्रकृति पर निर्भर नहीं करता बल्कि अधिशोषक और अधिशोष्य के बीच बनने वाले रासायनिक बंध पर निर्भर करता है। |
| निम्न ताप पर ही अधिशोषण होता है। | उच्च ताप पर भी अधिशोषण हो सकता है। |
| यह उत्क्रमणीय प्रकृति का होता है। | यह अनुत्क्रमणीय प्रकृति का होता है। |
| इसमें सक्रियण ऊर्जा का मान अधिक होना चाहिए। | इसमें सक्रियण ऊर्जा का मान अधिक नहीं होना चाहिए। |
| इस अधिशोषण में ऊष्मा का मान 20-40kJ प्रति मोल होता है। | इस अधिशोषण में ऊष्मा का मान 40-400 KJ प्रति मोल होता है। |
| ताप वृद्धि के साथ अधिशोषण का मान कम होता हैं। | ताप वृद्धि पर रासायनिक अधिशोषण की मात्रा पहले बढ़ती है फिर घटती है। |
भौतिक अधिशोषण के अभिलक्षण
- विशिष्टता की कमी :-अधिशोषक और अधिशोष्य के बीच दुर्बल वाण्डर बल होने के कारण यह किसी विशिष्ट गैस हेतु किसी प्रकार की विशिष्टता प्रदर्शित नहीं करती है।
- गैस की प्रकृति:- अधिशोषित होने वाली गैस की मात्रा गैस की प्रकृति पर निर्भर करती है।
- अधिशोषक की प्रकृति: अधिशोषक की प्रकृति इसके सतह के क्षेत्रफल करती है। जन्तु चारकोल, सिलिका जेल तथा ऐलुमिना को छिद्रयुक्त प्रकृति तथा उच्च सतह के क्षेत्रफल के कारण अच्छा अधिशोषक माना जाता है।
- अधिशोषण की एन्थैल्पी- अधिशोषक और अधिशोष्य के बीच दुर्बल वाण्डर वॉल होने के कारण भौतिक अधिशोषण की एन्थैल्पी का मान (20-40 KJmol-1) होता है।
- उत्क्रमणीय प्रकृति– किसी ठोस की सतह पर अधिशोषण उत्क्रमणीय प्रकृति का होता हैं।
- अधिशोषक का सक्रियण
रसायनिक अधिशोषण के अभिलक्षण
उच्च विशिष्टता:– अधिशोषक और अधिशोष्य के बीच रासायनिक बन्ध बनने के कारण यह अत्यन्त विशिष्ट प्रकृति का होता है अर्थात् यह विशिष्ट गैस का ही अधिशोषण करता है।
गैस की प्रकृति:- रासायनिक अधिशोषण तभी संभव है जब अधिशोषक और अधिशोषित होने वाली गैस के बीच किसी प्रकार का रासायनिक बन्ध संभव हो।
अधिशोषण की ऊष्मा:- इस अधिशोषण में अधिशोषक और अधिशोष्य के बीच रासायनिक बन्ध निर्माण के कारण इसमें ऊष्मा का मान 40-400KJ mold, होता है।
अनुक्रमणीय प्रकृति:- इसमें अधिशोषण एक ही दिशा में होता है क्योंकि इसमें बंध ऊर्जा अधिक होती है और बहुत अधिक मात्रा में ऊर्जा मुक्त होती है।
सतह का क्षेत्रफल:- रासायनिक अधिशोषण में अधिशोषक का क्षेत्रफल बढ़ने से अधिशोषण भी बढ़ जाता है।
अधिशोषण की अवस्था:- अधिशोष्य आण्विक अवस्था की तुलना में आयनिक अवस्था में होने अविशोषित होता है।
अधिशोषण समतापी वक्र
अधिशोषित गैस की मात्रा (x) और अधिशोषिक की मात्रा (m) अर्थात् x/m एवं दाब के बीच आरेखित ग्राफ को समतापी वक्र कहा जाता हैं।

फ्रॉयन्डलिक अधिशोषण समतापी वक्र – सन् 1909 में फ्रेण्डलिक ने समीकरण दिया जिसके अनुसार, निश्चित ताप पर गैस के अधिशोषण की मात्रा (x/m) और दाब (p) के बीच निम्न संबंध दिया

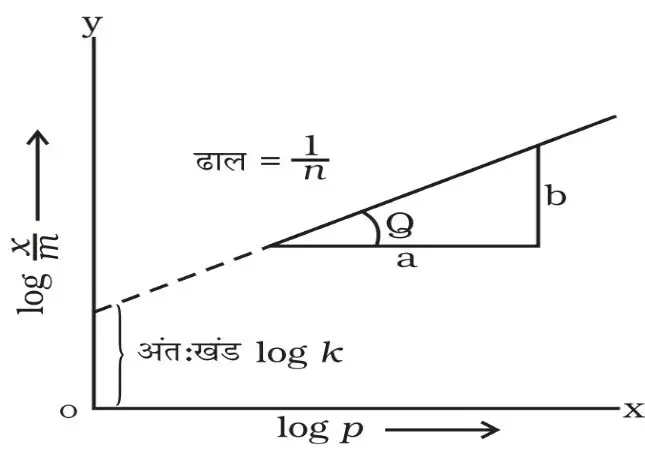
x= अधिशोष , m=द्रव्यमान , k एवं n = स्थिरांक
P = दाब
विलयन प्रावस्था से अधिशोषण
विलयन से अधिशोषण के व्यवहार को प्रभावित करने वाले कारक:
- अधिशोष्य और अधिशोषक की प्रकृति
- तापमान में वृद्धि के साथ सोखना कम हो जाता है।
- अधिशोषक का पृष्ठीय क्षेत्रफल। पृष्ठ क्षेत्रफल जितना अधिक होगा, अधिशोषण उतना ही अधिक होगा।
- विलयन में विलेय की सांद्रता।
अधिशोषण के अनुप्रयोग
- उच्च निर्वात उत्पन्न करने : कोई पात्र जिसको किसी निर्वात पम्प द्वारा वायु खींच ले या निर्वात कर लेते हैं को एक ऐसे पात्र से जोड़ दिया जाता है जिसमे द्रव वायु मे शीतित सक्रिय चारकोल रखा हुआ है जो शेष बची गैस, नमी आदि को शोषित कर लेता है।
- गैस मास्क : गैस मास्क में रखा सक्रिय चारकोल विषैली गैसों जैसे- CO2, S02, H2S, Co, CH3, NH3) को अधिशोषित कर लेती है और उसमें से शुद्ध वायु प्रवाहित होती है।
- आद्रता को कम करने : सिलिका जेल व ऐलुमिना जेल का उपयोग कक्ष की आर्द्रता (नमी) को अधिशोषित करने के लिए किया जाता है।
- रंगीन अशुद्धियों को हटाने : सक्रिय चारकोल का उपयोग शर्करा, पेट्रोलियम उद्योगों में बहुतायत होता है। शर्करा उद्योग में रंगीन शर्करा रंगीन पदार्थ का अधिशोषित कर लेता है।
- विषमांगी उत्प्रेरण : बारीक चूर्ण के रूप में आयरन व निकिल उत्प्रेरक का उपयोग क्रमशः अमोनिया व वनस्पति घी के निर्माण में किया जाता है।
- अक्रिय गैसों को पृथक्क करना : नारियल चारकोल अक्रिय गैसों के मिश्रण में से अक्रिय गैसों को पृथक्क करने के काम आता है।
- व्याधियों के उपचार : कुछ दवाइयाँ कीटाणुओं को अधिशोषित कर लेते है।
- वर्ण लेखिकी : ठोस अधिशोषक मिश्रण के घटको को पृथक्क करने के काम आता है।
उत्प्रेरण
वह पदार्थ जो किसी रासायनिक अभिक्रिया में उपयोग हुए बिना अभिक्रिया के वेग में परिवर्तित कर देता है, उत्प्रेरक कहलाता है।
अभिक्रिया के वेग के परिवर्तित होने की घटना जो उत्प्रेरक के उपयोग से होती है, उत्प्रेरण कहलाता है।
2KClO3 → 2KCl + 3O2
जब उत्प्रेरक सक्रियण ऊर्जा को कम कर देता है तब अभिक्रिया की दर बढ़ जाता है तथा जब उत्प्रेरक सक्रिय ऊर्जा को बढ़ा देता है तो अभिक्रिया की दर घट जाता है।
समांगी उत्प्रेरण और विषमांगी उत्प्रेरण
समांगी उत्प्रेरक :- रासायनिक अभिक्रिया में अभिकारक व उत्प्रेरक समान प्रावस्था में है, तो इसे समांगी उत्प्रेरण कहते है।
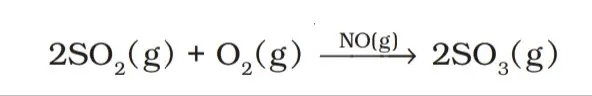
विषमांगी उत्प्रेरण :- जब अभिकारक तथा उत्प्रेरक अलग-अलग प्रावस्था में होते हैं तो इसे विषमांगी उत्प्रेरण कहलाते है।

विषमांगी उत्प्रेरण का अधिशोषण सिद्धांत
विषमांग उत्प्रेरण का अधिशोषण एक पृष्ठीय घटता है जिसके निम्न पद हैं:-
- उत्प्रेरक की सतह पर अभिकारकों का विसरण होता है।
- उत्प्रेरक की सतह (सक्रिय केंद्रों) पर अभिकारक अणुओं का अधिशोषण होता है।
- उत्प्रेरक की सतह (पृष्ठ) पर रासायनिक अभिक्रिया सम्पन्न होती है। उत्पाद का निर्माण होता है।
- उत्पाद अणुओं का पृष्ठ से विशोषण होता है।
- उत्प्रेरक की सतह से उत्पाद का बाहर विसरण हो जाता है।

जिओलाइट का आकार प्रेरणात्मक उत्प्रेरण :-
ऐसा उत्प्रेरक जिसकी रन्ध्र या छिद्र की संरचना तथा आकार अभिकारक एवं उत्पाद की अणुओं के आकार पर निर्भर करती है, इस प्रकार के उत्प्रेरकों को आकृति चयन उत्प्रेरक कहते हैं।
जैसे:- जिओलाइट।
जियोलाइट एक ऐसा उत्प्रेरक है जिसमें छोटे-छोटे छिद्र या गुहिकाएँ होती हैं। गुहिकाएँ अपने व्यास के आधार पर अभिकारक का चयन करता है और उसी आकार के उत्पाद का निर्माण करता है।
एंजाइम उत्प्रेरण
एंजाइम जीवित स्पीशीज में पाए जाने वाले नाइट्रोजन युक्त उच्च अणुभार वाले कार्बनिक संकुल यौगिक है जो जैविक रासायनिक अभिक्रियाओं को उत्प्रेरित करते हैं।
एंजाइम उत्प्रेरण के अभिलक्षण
- एन्जाइम उत्प्रेरित द्वारा अभिक्रिया का वेग लगभग 108 से 1020 गुना बढ़ जाती है।
- एन्जाइम की अल्प मात्रा ही आवश्यका होती है।
- एन्जाइम निश्चित PH पर अधिक कार्यक्षमता होती है।
- निश्चित तापमान पर ही एन्जाइम कार्य करती (35-37°C)।
- एन्जाइम अति विशिष्ट प्रकृति का होता है अर्थात एक विशिष्ट एन्जाइम एक ही अभिक्रिया को उत्प्रेरित कर सकता है।
- एन्ज़ाइम की सक्रियाता को नियंत्रित करने के लिए कार्बनिक या अकार्बनिक अणुओं का प्रयोग किया जाता है।
- एन्ज़ाइम की उत्प्रेरक सक्रियाता को सक्रियक या सहएंजाइम के द्वारा बढ़ायी जा सकती है।
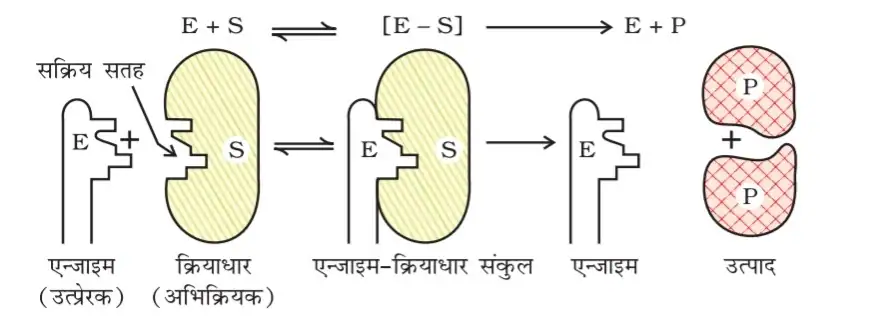
एंजाइम उत्प्रेरक की क्रियाविधि :- यह दो पदों में सम्पन्न होती है –
प्रथम पद:- सब्सट्रेट एन्जाइम से संयोग कर संकुल बनाता है जो अस्थायी तथा क्रियाशील होता है।
द्वितीय पद:- एन्जाइम सब्सट्रेट यौगिक टूटकर उत्पाद का निर्माण करता है तथा एन्जाइम अलग हो जाता है।
उद्योगों में उत्प्रेरक
एक उत्प्रेरक विभिन्न रासायनिक और औद्योगिक अनुसंधानों के साथ-साथ अनुसंधान प्रयोगशालाओं में महत्वपूर्ण भूमिका निभाता है। कुछ उत्प्रेरक हैं जो लगातार विकसित हो रहे हैं और बहुत मांग में हैं। उत्प्रेरक का सबसे अच्छा उपयोग हानिकारक रसायन को अधिक पर्यावरण अनुकूल वैकल्पिक विधि से बदलना है।
कोलॉइड
वे विलयन जिसके विलेय कणों का आकार 1nm से 1000 nm तक होता है, कोलायडी विलयन कहलाते है।
कोलायडी कणों का आकार वास्तविक विलयन के कणों के आकार से बड़ा किन्तु निलम्बन कणों के आकार से छोटा होता है।
कोलॉइड का वर्गीकरण
1.भौतिक अवस्थाओं के आधार पर
- ठोस सॉल – जिसमें एक ठोस पदार्थ के कण दूसरे ठोस पदार्थ के कणों में बिखर जाते हैं।
- सॉल – जब परिक्षेपण माध्यम ठोस होता है और परिक्षेपण चरण कोलाइडल प्रणाली में तरल होता है, इसे सॉल कहा जाता है। जैसे पेंट, स्याही, गोल्ड सोल, सिल्वर सोल, स्टार्च, आदि।
- ठोस ऐरोसोल – जिसमें ठोस कणों के अति सूक्ष्म कण गैस में परिक्षेपित हो जाते हैं, ठोस ऐरोसोल कहलाते हैं। जैसे धुआँ, धूल भरी आंधी, उद्योगों से निकलने वाला धुंआ आदि।
- जैल – एक कोलाइडल घोल जिसमें तरल की बूंदों को एक ठोस परिक्षेपण माध्यम में फैलाया जाता है। जैसे जेली, पनीर, दही, आदि।
- ठोस झाग – एक कोलाइडल घोल जिसमें गैस के सूक्ष्म कण ठोस फैलाव माध्यम में घुल जाते हैं। जैसे झांवा, रबर, केक, आदि।
अनोन्यक्रिया की प्रकृति के आधार पर
- लियोफिलिक कोलाइड्स:– इस प्रकार के कोलाइडल समाधानों में परिक्षिप्त चरण के कणों और परिक्षिप्त माध्यम के कणों के बीच मजबूत संबंध होता है। जैसे – गोंद, स्टार्च, जिलेटिन और प्रोटीन। आदि।
- लियोफोबिक कोलाइड्स:– इस प्रकार के कोलाइडल समाधानों में परिक्षिप्त चरण के कणों और परिक्षेपण माध्यम के कणों के बीच कमजोर संबंध होता है। जैसे सिल्वर सोल, फेरिक हाइड्रॉक्साइड सॉल आदि।
सोल कणों के गुणों के आधार पर
- बहुआण्विक कोलाइड्:- जब पदार्थ के छोटे परमाणु घुल जाते हैं और एक प्रजाति बनाने के लिए गठबंधन करते हैं जिसका आकार कोलाइडल आकार की सीमा में होता है, बहु-आणविक कोलाइड्स के रूप में जाना जाता है। जैसे:- हजारों एस 8 कणों के साथ सल्फर समाधान।
- वृहदआण्विक कोलाइड्स:- बायोमोलेक्यूलर जैसे एंजाइम जो एक उचित फैलाव में डुबोए जाने पर आकार में बड़े होते हैं, मैक्रोमोलेक्युलर कोलाइड्स के रूप में जाने जाते हैं। जैसे रबर, सेल्युलोज, स्टार्च आदि।
- सहचारी कोलाइड्स ( मिसेल):- कुछ पदार्थ ऐसे होते हैं जिनके अणु द्विफिलिक प्रकृति के होते हैं, इन कणों के अणुओं में एक गैर-ध्रुवीय हाइड्रोफिलिक भाग और एक ध्रुवीय हाइड्रोफोबिक भाग होता है।

कोलॉइड बनाना
1.रासायनिक विधियाँ– इनसे विभिन्न प्रकार के कोलॉइडी पदार्थो के कोलॉइडी विलयन प्राप्त किए जाते है जो मुख्यता रासायनिक क्रियाओं पर आधारित होता है।

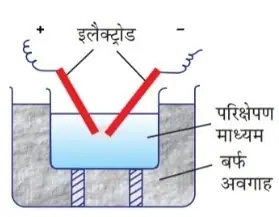
2.ब्रेडिग आर्क विधि:-
स्वर्ण (AW), रजत (Ag), कॉपर (Cu) तथा अन्य धातुओं के कोलाइडी विलयन प्रायः इसी विधि द्वारा बनाए जाते हैं।
इस विधि में दो धातु के इलेक्ट्रोडों को द्रव माध्यम में लगा दिया जाता है तथा दोनों के बीच एक विद्युत आर्क उत्पन्न किया जाता है।
धातुओं के परमाणु वाष्पित होते हैं तथा ठण्डा होने पर आपस में मिलकर, संघनित होकर कोलॉइडी कण के आकार के कणों में परिवर्तित हो जाते है।
3.पेप्टन विधि:-
ताजा बने हुए अवक्षेप में उसके समआयन युक्त विद्युत-अपयट्य मिलाकर कोलॉइडी विलयन में परिवर्तन, पेप्टीकरण कहलाता है। यह अवक्षेपण की विपरीत क्रिया है। प्रयुक्त विद्युत- अपघट्य पेप्टीकारक कहलाता है।
कोलाइडी विलयन का शुद्धिकरण
- अपोहन विधि :- अपोहन या डायलिसिस (by dialysis) कोलॉइडी विलयनों में विद्यमान क्रिस्टलीय अशुद्धि को जन्तु झिल्ली या वनस्पति झिल्ली में से जल प्रवाह के साथ दूर करने की विधि को अपोहन (डायलिसिस) कहते हैं। अपोहन में प्रयुक्त होने वाले उपकरण को डायलाइजर कहा जाता हैं। शुद्धियाँ जल में विसरण द्वारा बाहर निकल जाती है।
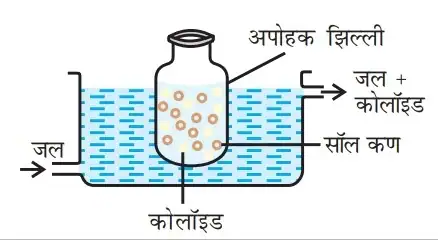
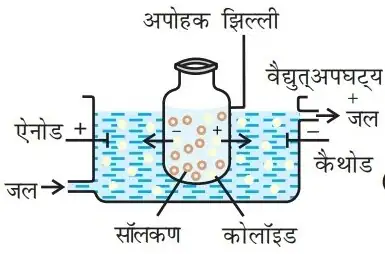
- विद्युत परीक्षेपण विधि :– इस विधि से धातु का कोलाइडी विलयन बनाया जाता है। उसे छड़ के रूप में लेकर सोडियम हाइड्रोक्साइड के तनु विलयन में डुबोया जाता है। तथा इस में विद्युत धारा प्रवाहित की जाती है। जिसमें धातु की छड़ से छोटे-छोटे कणों उत्पन्न होते हैं। यह कण सोडियम हाइड्रोक्साइड के तनु विलयन में मिलकर कोलाइडी विलयन का निर्माण करते हैं।
- अति सूक्ष्म फिल्टर :- इस विधी में अशुद्ध कोलाइडी विलयन पेपर की सहायता से लिया जाता है। फिल्टर पेपर में से शुद्ध कोलाइडी विलयन बाहर निकल जाता।
कोलाइड विलयन का गुण
- अणुसंख्यक गुणधर्म :- कोलॉइडी कणों का अणु भार अधिक होता है। प्रति लिटर कोलॉइडी कणों की संख्या वास्तविक विलयन से कम होती है एवं ये विलयन शुद्ध परिक्षेपण माध्यम के समान तापक्रम पर उबलते तथा जमते हैं। इनके वाष्प-दाब में अवनमन भी नगण्य होता है।
- टिण्डल प्रभाव– कोलॉइडी विलयन में प्रकाश गुजारने से किरण का मार्ग चमकने लगता है। जिसे टिण्डल प्रभाव या फैराडे टिण्डल प्रभाव कहते हैं। कोलॉइड कणों के आकार पर टिण्डल प्रभाव निर्भर करता है। इस प्रभाव को फैराडे ने सन् 1869 में विस्तारपूर्वक अध्ययन किया था।


- ब्राउनी गति:– कोलाइडी कणों का अनियमित दिशा में गति को ब्राउनी गति कहते हैं। कारण- ब्राउनी गति, कोलॉइडी कणों पर परिक्षेपण माध्यम के कणों द्वारा असमान बौछार या प्रहार के कारण होती हैं।
- विद्युत कण संचलन:- कोलॉइडी विलयन में विद्युत धारा प्रवाहित करने पर कोलॉइड कण अपने आवेश के विपरीत आवेश के इलेक्ट्रोड की ओर गति करती है और वहाँ (उस इलेक्ट्रॉन) पर जाकर उदासीन कण बना लेता है इस संपूर्ण प्रक्रिया को विद्युत कण संचलन या धन कण संचलन कहते हैं।

- स्कन्दन :- कोलॉइडी विलयन में विद्युत अपघट्य मिलाने पर कोलॉइडी कणों का नीचे बैठ जाने की क्रिया कोलॉइड का स्कंदन या अवक्षेपण कहलाता है। कारण :- आवेश के आधार पर कोलॉइड कण धनात्मक कोलाइड तथा ऋणात्मक कोलॉइड होते हैं।
- स्थायी प्रकृति – कोलॉइडी विलयनों की प्रकृति स्थाई रहती है। इनके कण गतिमान अवस्था में रहते हैं ।
इमल्सन
दो अमिश्रणीय द्रवो के कोलॉइड विलयन को पायस कहते हैं। इसमें परिक्षिप्त व परिक्षेपण दोनों ही द्रव अप्रावस्था में होते है। यह द्रवविरोधी कोलॉइड है।
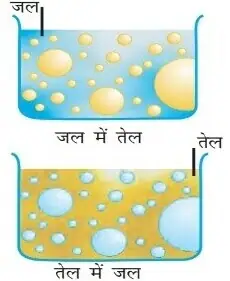
दो अमिश्रणीय द्रवों को स्थायी बनाये रखने के लिए तीसरे पदार्थ को पायसीकारक कहा जाता है।
उदा० : साबुन, जिलेटिन।
हमारे चारो ओर कोलाइड विलयन
- आकाश का नीला रंग: हवा में निलंबित पानी के साथ धूल के कण नीले प्रकाश को बिखेरते हैं जो हमारी आंखों तक पहुंचता है और आकाश नीला दिखाई देता है।
- कोहरा, धुंध और बारिश: जब धूल के कणों वाली हवा के बड़े द्रव्यमान को उसके ओस बिंदु से नीचे ठंडा किया जाता है, तो हवा से नमी कणों की सतहों पर घनीभूत हो जाती है, जिससे महीन बूंदें बनती हैं। क्योंकि बूंदों की प्रकृति कोलाइडल होती है, वे धुंध के रूप में हवा में तैरती रहती हैं। बादल एरोसोल होते हैं जो हवा में निलंबित पानी की छोटी बूंदों से बने होते हैं। ऊपरी वायुमंडल में संघनन के कारण, पानी की कोलाइडल बूंदें आकार मे हो जाती हैं जब तक कि वे बारिश के रूप में नहीं गिरतीं। वर्षा तब होती है जब दो विपरीत आवेशित बादल टकराते हैं।
- खाद्य पदार्थ: दूध, मक्खन, हलवा, आइसक्रीम, फलों के रस आदि सभी कोलाइड हैं।
- रक्त:– वर्णक भाग में एल्ब्यूमिन होता है, जो छितरे हुए चरण के रूप में कार्य करता है, और पानी फैलाव माध्यम के रूप में कार्य करता है। यह एक प्रकार का हाइड्रोसोल है।
- मिट्टी: उपजाऊ मिट्टी प्रकृति में कोलाइडल होती है, जिसमें ह्यूमस एक सुरक्षात्मक कोलाइड के रूप में कार्य करता है। मिट्टी कोलाइडल प्रकृति के कारण नमी और पोषक तत्वों को अवशोषित करती है।
- डेल्टा का निर्माण:– नदी का जल कोलाइडी मिट्टी का विलयन है। समुद्री जल में विभिन्न प्रकार के इलेक्ट्रोलाइट्स पाए जा सकते हैं।
कोलाइड्स के अनुप्रयोग
- दवाएं: कोलाइडल दवाएं शरीर के ऊतकों द्वारा अधिक आसानी से अवशोषित होती हैं और इस प्रकार अधिक प्रभावी होती हैं।
- साबुन की सफाई क्रिया: साबुन के घोल में कोलाइडल संरचना होती है। यह सोखने के माध्यम से गंदगी के कणों को हटा देता है या कपड़े का पालन करने वाले चिकना पदार्थ को हटा देता है।
- जल शोधन: फिटकरी जैसे कुछ इलेक्ट्रोलाइट्स का उपयोग पानी में कोलाइडल अशुद्धियों को दूर करने के लिए किया जा सकता है।
- रबर उद्योग: लेटेक्स रबर उद्योग में उपयोग किए जाने वाले नकारात्मक रूप से चार्ज किए गए रबर कणों का एक कोलाइडल समाधान है।
- सीवेज निपटान:– गंदगी, मिट्टी और अन्य सामग्रियों के कोलाइडियल कणों में इलेक्ट्रिक चार्ज होता है।
- कृत्रिम वर्षा: एक बादल पर विपरीत आवेशित कोलाइडल धूल के कणों के छिड़काव से कृत्रिम वर्षा हो सकती है। बादल में कोलाइडल पानी के कण असर कम हो जाएंगे और पानी की बड़ी बूंदों के रूप में जमा हो जाएंगे और कृत्रिम बारिश होगी।
- झाग तैरने की प्रक्रिया : धातुकर्म प्रक्रियाओं में झाग तैरने की प्रक्रिया द्वारा अयस्क की सांद्रता पाउडर अयस्क के तेल पायस के उपचार पर आधारित होती है।
More Resources:-
Class 12 Chemistry Chapter 4 Notes in Hindi रसायनिक बलगतिकी
Class 12 Chemistry Chapter 3 Notes in Hindi वैधुतरसायन
Class 12 Chemistry Chapter 2 Notes in Hindi विलयन
Class 12 Chemistry Chapter 1 Notes in Hindi ठोस अवस्था
We hope Class 12 Chemistry Chapter 5 Notes in Hindi will help you. If you have any questions regarding Class 12 Chemistry Chapter 5 Notes in Hindi feel free to ask in the comment section.
Tagged with: Chemistry chapter 5 class 12 notes in hindi | Chemistry class 12 chapter 5 in hindi notes | Chemistry class 12 chapter 5 notes in hindi | class 12 Chemistry chapter 5 ncert notes in hindi | Class 12 Chemistry Chapter 5 Notes in Hindi | surface chemistry notes in hindi