यहाँ हमने Class 12 Chemistry Chapter 5 Notes in Hindi दिये है। Class 12 Chemistry Chapter 5 Notes in Hindi आपको अध्याय को बेहतर ढंग से समझने में मदद करेंगे और आपकी परीक्षा की तैयारी में सहायक होंगे।
Class 12 Chemistry Chapter 5 Notes in Hindi
योगात्मक यौगिक :- दो या दो से अधिक सरल लवण के एक निश्चित अनुपात में जुड़ने से बनने वाले यौगिक योगात्मक यौगिक कहलाते है।
ये दो प्रकार के होते है –
(i) द्विक लवण (Double salt):- ऐसे योगात्मक यौगिक जो केवल ठोस अवस्था में स्थायी होते किन्तु द्रव मे घुलने पर अपने अवयवी भागो मे विभक्त हो जाते हैं, द्विक लवण कहलाते है।
(ii) उपसहसंयोजक यौगिक या संकुल यौगिक (Co-ordinate Compound):-
ऐसे यौगिक जो ठोस तथा द्रव दोनो अवस्थाओ मे अपने स्थायित्व को बनाये रखते है तथा ऐसे यौगिक जिनमे कुछ परमाणु परमाणु समूह तथा आयन किसी परमाणु से उप सहसंयोजन बंध द्वारा जुड़े रहते है, उपसंहसंयोजक यौगिक कहलाते हैं।
उदा० – K4 [Fe (CN)6] , [Co (NH3)6] Cl3 इत्यादि
द्विक लवण तथा उपसहसंयोजक यौगिक में अन्तर:-
| द्विक लवण | उपसहसंयोजक यौगिक |
|---|---|
| यह केवल ठोस अवस्था में स्थापी होते है। | ये ठोस तथा द्रव दोनो अवस्थाओ मे स्थायी होते है। |
| यह अपने अवयती भागो के गुणो को दर्शाते है। | यह अपने अवयवी भागो के गुणों को नही दर्शाता है। |
| ये अपने सभी आयनो में आयनित हो जाते हैं। | ये विलयन में सभी आयन नही देते है। |
| इसके विलवन में सभी आयनो का परीक्षण सम्भव है। | इसके विलयन में सभी आयनो का परीक्षण सम्भव नहीं है। |
कुछ महत्वपूर्ण शब्द:-
केन्द्रीय धातु परमाणु: वे धातु परमाणु जो कुछ परमाणु, परमाणु समूहो अथवा आयनो से उपसहसंयोजक बन्ध द्वारा जुड़े होते है, केन्द्रीय धातु परमाणु (Central metal atom) कहलाते है। सामान्यतः ये d या f ब्लाक के होते हैं।
सहआयन (Counter ion):- किसी संकुल यौगिक में वह भाग जो बड़े कोष्ठक के बाहर लिखा होता है, सहआयन कहलाता है।
उपसहसंयोजक परिसर या संकुल क्षेत्र (Co-ordination Region):- किसी संकुल यौगिक का वह भाग जिसमे केन्द्रीय धातु परमाणु तथा लिगेण्ड उपस्थित होते है, संकुल क्षेत्र कहलाता है। यह बड़े कोष्ठक के अन्दर लिखा जाता है।
सकुल क्षेत्र तीन प्रकार के होते है
- (i) धनावेशित संकुल क्षेत्र – [Co(NH3)6]3+ , [Zn(NH3)4]2+ इत्यादि ।
- (ii) ऋटनावेशित संकुल क्षेत्र – [Fe(CN)6]4- , [Co(CN)6)3- आदि ।
- (ii) उदासीन संकुल क्षेत्र – [Ni(CO)4], [Fe(CO)5] आदि ।
उपसहसंयोजक संख्या:- किसी संकुल यौगिक में केन्द्रीय धातु परमाणु लिगेण्डो द्वारा, जितने उपसंहसंयोजक बन्ध से जुड़ा होता है, यौगिक की उपसंहसंयोजक संख्या कहलाती है।
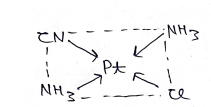
उपसहसंयोजक संख्या = 4
लिगेण्ड (ligand):- वे परमाणु , परमाणु समूह अथवा आयन जो धातु परमाणु से उपसहसंयोजक बन्ध बनाते है, लिगेण्ड कहलाते है। लिगेण्ड धातु परमाणु को दों e– अर्थात एक e– युग्म दान करते है।
दन्तुकता (Denticity):- किसी भी लिगेण्ड द्वारा बनाए जाने वाले उपसहसंयोजक बन्धों की संख्या उसकी दन्तुकता कहलाती है।
दन्तुकता के आधार पर लिगेण्ड के प्रकार-
(i) एकदन्तुक लिगेण्ड (monodentate ligand):- ऐसे लिगेण्ड जिनके पास केवल एक दाता परमाणु होते है अर्थात वो केंद्रीय धातु परमाणु से केवल एक उपसहसंयोजक बन्ध बनाता है। उदा०→ F–, OH–, Cl–, Br–, I–, NO–2, SCN–, CO, NC–, NH3, CH3. – NH2_, Pyridine(Py)
(ii) द्विदन्तुक लिगेण्ड (Bidentate Ligand):- ऐसे लिगेण्ड जिनके पास केवल दो दाता परमाणु होते है अर्थात वो केन्द्रीय धातु परमाणु से दो उपसहसंयोजक बन्ध बनाता है, द्विदन्तुक लिगेण्ड कहलाता है।
उद0 –
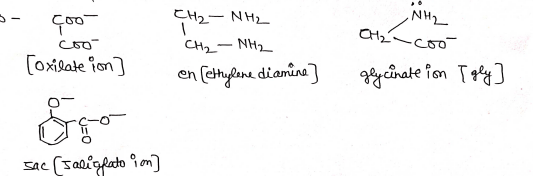
(iii) त्रिदन्तुक लिगेण्ड(Tridentate Ligand):- ऐसे लिगेण्ड जिनके पास केवल तीन दाता परमाणु होते है अर्थात वो केन्द्रीय धातु परमाणु से तीन उपसहसंयोजक बन्ध बनाता है त्रिदन्तुक लिगण्ड कहलाता है।
उदा०

(iv) चतुष्दन्तुक लिगेण्ड (Tetra Dentate ligand):- ऐसे लिगेण्ड जिनके पास केवल चार दाता परमाणु होते है अर्थात वो केन्द्रीय धातु परमाणु से चार उपसहसंयोजक बन्ध बनाता है। चतुष्दन्तुक लिगेण्ड कहलाता है
उदा० –

(v) पंचदन्तुक लिगेण्ड (Penta dentate Ligand):- ऐसे लिगेण्ड जिनके पास पांच दाता परमाणु होते है, अर्थात वो केन्द्रीय धातु परमाणु से पांच उपसहसंयोजक बन्ध बनाता है पंचदन्तुक लिगेण्ड कहलाता है।
उदा० –

(vi) षष्ठदन्तुक लिगेण्ड (Hexa dentate Ligand):- ऐसे लिगण्ड जिनके पास छः दाता परमाणु होते है अर्थात वो केन्द्रीय धातु परमाणु से छः उपसहसंयोजक बन्ध द्वारा जुड़ा होता है षष्ठदन्तुक लिगेण्ड कहलाता है।
उदा०

(vii) उभयदन्तुक लिगण्ड (Ambi dentate Ligand):- ऐसे लिगेण्ड जिनके पास दो दाता परमाणु होते है, परन्तु वह एक बार में एक ही परमाणु से उपसहसंयोजक बच्घ द्वारा जुड़ सकते है, उभयदन्तुक लिगेण्ड कहलाते है।
उदा० –
- (i) [NO2 –], [ONO–]
- (ii) (CN–], [ONO–]
- (iii) [SCN–], [NCS–]
आवेश के आधार पर लिगेण्ड –
- (1) ऋणावेशित लिगेण्ड- Cl–, F–, Br–, OH–, NO2–
- (2) धनावेशित लिगेण्ड – NO+
- (3) उदासीन लिगेण्ड – CO, NH3,CH3 , NH2
लिगेण्ड के आधार पर संकुल के प्रकार:-
(i) समरूप लिगेण्ड संकुल (Homoleptic Complex):- जब संकुल के अन्दर उपस्थित सभी लिगेण्ड समान प्रकार के होते है तो इसे होमोलेप्टिक संकुल कहते है। उदा०- [Fe(CN)6]4- , [Co(NH3)6 ] 3+ इत्यादि।
(ii)असमरूप लिगेण्ड संकुल (Hetroleptic Complex):- जब संकुल के अन्दर उपस्थित सभी लिगेण्ड असमान प्रकार के होते है तो हेटरोप्लिटिक संकुल बनता है।
उदा० – Pt Cl2 (NH3)2
उपसहसंयोजक / समन्वय बहुफलक (Co-ordination Polyhedron)
जब लिगेण्ड धातु परमाणु से उपसहसंयोजक बन्ध द्वारा जुड़ते है तो यौगिक की एक निश्चित ज्यामिति प्राप्त होती है जिसे बहुफलक कहते है। यह चतुष्फलकीय वर्ग समतलीय अण्ठफलकीय आदि प्रकार के हो सकते हैं।
उदा० –
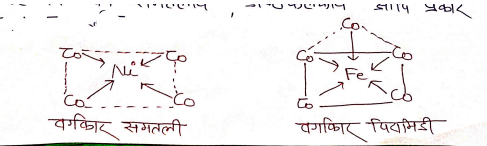
कीलेट तथा कीलेटीकरण (Chelate and chelation): –
जब द्विदन्तुक या बहुदन्तुक लिगेण्ड किसी धातु से उपसहसंयोजक बन्ध द्वारा जुड़ते है तो वहां पर एक वलयाकार संरचना का निर्माण होता है इसे कीलेट कहते हैं, और यह लिगण्ड कीलेटोकारक लिगेण्ड है कहलाता है तथा यह प्रक्रिया कीलेटीकरण कहलाता है, इस प्रक्रिया में प्राप्त संकुल कीलेटित संकुल कहलाता हैं |
उदा०

कीलेट प्रभाव:- कीलेट यौगिक सामान्य उपसहसंयोजक यौगिको की तुलना मे अधिक स्थायी होते हैं इसे कीलेट प्रभाव कहते है
कीलेट के गुण:-
- ये सामान्य संकुलों की तुलना में अधिक स्थायी होते है।
- इनका प्रयोग कठोर जल को मृदु बनाने में किया जाता है।
- इसका प्रयोग धातुओं (जैसे – Ni2+, Cu2+, Mg2+ आदि)के आंकलन मे किया जाता है।
- इसका प्रयोग लथेनाइड तथा एक्टिनाइड के पृथक्करण में किया जाता है।
प्रभावी परमाणु क्रमांक (Effective Atomic No) (EAN):-
यह नियम सिडविक ने दिया था।
किसी उपसहसंयोजक यौगिक के बनने के पश्चात इसमे उपस्थित केन्द्रीय धातु परमाणु के संयोजी कोश मे उपस्थित कुल e– की संख्या उसका प्रभावी परमाणु क्रमांक कहलाती है।
सामान्यतः यह धातु परमाणु के निकटतम अक्रिय गैस के परमाणु क्रमांक के बराबर होती है।
(EAN = धातु परमाणु का परमाणु क्रमांक – धातु की ऑक्सीकरण संख्या + लिगेण्डो द्वारा प्राप्त e– की संख्या)
उपसहसंयोजक यौगिको का IUPAC नामकरण: –
- (I) सर्वप्रथम घनायन का नाम लिखते है चाहे वह सहआयन हो या संकुल आयन हो।
- (II) यदि घनावेशित भाग सहआयन है तो उसका नाम बिना उसकी संख्या दर्शाए लिख दिया जाता है।
- (III) संकुल का नाम लिखते समय सबसे पहले लिगेण्डो के नाम लिखते है।
- (IV) यदि संकुल के अन्दर सभी लिगेण्ड समान है तो उनका एक से अधिक बार आने पर उनके नाम के पहले di, tri, tetra, Penta, Hexa आदि पूर्वलग्नों का प्रयोग करते हैं।
- (V) यदि किसी लिगण्ड के नाम से पहले ही di, tri, tetra, आदि उपस्थित हो तो उसके एक से अधिक बार आने की स्थिति में Bis = 2, tis = 3, tetrakis = 4, Pentakis =5 आदि का प्रयोग करते है।
- (VI) यदि संकुल के अन्दर एक से अधिक प्रकार के लिगेण्ड उपस्थित हो तो उनका नाम Alphabetical order मे लिखते है।
- (VII) लिगेण्डो के नाम के पश्चात केन्द्रीय धातु परमाणु के नाम लिखते है।
- (VIII) यदि संकुल धनावेशित या उदासीन हो तो धातु परमाणु का सामान्य नाम लिखा जाता है तथा उसके साथ उसकी ऑक्सीकरण संख्या रोमन अंको मे लिखी जाती है।
- (ix) यदि संकुल ऋणावेशित हो तो धातु परमाणु के नाम के अन्त ate लगा देते है तथा उसके साथ आक्सीकरण संख्या रोमन में लिखते है।
- (X) अन्त में ऋणावेशित सहआयन का नाम लिखा जाता है ।
लिगेड तथा उनके IUPAC नाम

समावयवता (Isomerism) : –
दो या दो से अधिक ऐसे यौगिक जिनके अणुसूत्र समान किन्तु भौतिक एवं रासायनिक गुण अलग -अलग होते है, समावयवी यौगिक कहलाते है तथा यह गुण समावयवता कहलाती है |

1. संरचनात्मक समावयवता
(i) आयनन समावयवता:- समान अणुसूत्र वाले वे यौगिक जो विलपन में अलग-अलग आयन देते हैं, आयनन समावयवी कहलाते है तथा यह गुण आयनन समावयतता कहलाती है |
(ii) हाइड्रेट समावयवता:- समान अणुसूत्र वाले वे यौगिक जिनमे संकुल के अन्दर तथा बाहर जल के अणुओ की संख्या मे परिवर्तन के कारण समावयवता उत्पन्न होती है, हाइड्रेट समावयवता कहलाती है।
उदा० – (Zn(H20) 4 ] Cl2 , [Zn(H20)3 ]ClH20
(iii) बन्धन समावयवता (Linkage Isomer):- यह समावयवता उन यौगिको में पायी जाती है जिनमें उभयदन्तुक लिगेण्ड पाये जाते है। यह समावयवता उभयदन्तुक लिगण्ड के अलग-अलग परमाणुओ के केन्द्रीय धातु परमाणु से बन्ध बनाने के कारण उत्पन्न होती है।
(iv) बहुलकीकरण समावयवता:- ऐसी समावयवता उन यौगिकों मेंपायी जाती है, जिनके रासायनिक संघटन तथा परमाणुओं की संख्याओ का अनुपात समान होता है, बहुलकीकरण समावयवता कहलाती है।
(v) उपसहसंयोजक समावयवता:- ऐसी समावयवता उन यौगिको में पायी जाती है, जिनमे धनावन तथा ऋणायन दोनो ही संकुल होते है। यह समावयवता दोनो संकुल के केन्द्रीय परमाणुओ द्वारा अपने अपने लिगेण्डो के आदान- से उत्पन्न होती है।
(vi) उपसहसंयोजक स्थान समावयवता:- यह समावयवता उन यौगिको में पायी जाती है जिनमें सेतु बन्ध लिगेण्ड उपस्थित होते है। इसमे समावयवता सेतु बन्ध लिगण्ड से जुड़े धातु परमाणुओ के आपस में लिगेण्ड ( असेतु बन्ध लिगण्ड) के आदान प्रदान से उत्पन्न होती है।
2. त्रिविम समावयवता (stereo Isomerism):-
ऐसी समावयवता जो केन्द्रीय धातु परमाणु के चारो ओर उपस्थित लिगेण्ड की आकाशीय व्यवस्था में भिन्नता के कारण उत्पन्न होती है, तो इसे त्रिविम समावयवता कहते है। ये दो प्रकार के होते है
- ज्यामितीय समावयवता
- प्रकाशिक समावयवता
(i) ज्यामितीय समावयवता:- ऐसी समावयवता जो केन्द्रीय धातु परमाणु के चारो ओर उपस्थित लिगेण्डो की पारस्परिक स्थिति मे भिन्नता के कारण उत्पन्न होती है, ज्यामितीय समावयवता कहलाती है।
इसके दो रूप होते हैं
- (a) समपक्ष (Cis Form):- जब केन्द्रीय परमाणु के चारो ओर उपस्थित समान लिगेण्ड समान दिशा मे उपस्थित होते हैं, तो इसे समपक्ष रूप कहते है।
- (b) विपक्ष रूप (Transform):- जब केन्द्रीय धातु परमाणु के चारो ओर उपस्थित समान लिगेण्ड विपरीत दिशा में उपस्थित होते है, तो इसे विपक्ष रूप समावयवी कहते हैं।
उपसहसंयोजक संख्या 4 वाले यौगिको में ज्यामितीय समावयवता:-
(i) यौगिक जो ज्यामितीय समावयवता नहीं दर्शाएंगे —
- (a) जिनमें चारो लिगेण्ड समान प्रकार के होगे। [MA4]
- (b) जिनमें कोई तीन लिगेण्ड समान प्रकार के हो। [MA3B]
- (c) जिन यौगिको मे सममित द्विदन्तुक लिगेण्ड उपस्थित हो। [pt (en)2]2+
- (d) वे यौगिक जिनकी संरचना त्रिभुजीय पिरामिडी होती है ।
(ii) वे यौगिक जो ज्यामितीय समावयवता दर्शाते है:-
- (a) वे यौगिक जिनमें दो-दो लिगेण्ड समान प्रकार के होते है। [pt Cl2 (NH3)2]
- (b) वे यौगिक जिनमें दो लिगेण्ड समान तथा दो अलग-अलग लिगेण्ड होते है।
उपसहसंयोजक संख्या 6 वाले यौगिको में ज्यामितीय समावयवताः
- (a) जिन यौगिको में सभी लिगेण्ड एक समान प्रकार के होते है, वे ज्यामितीय समावयवता नही दर्शाते है ।
- (b) वे यौगिक जिनमें 5 लिगेण्ड समान प्रकार के होते हैं, वे भी ज्यामितीय समावयवता नहीं दर्शाते है ।
- (c) [MA4 B2], [MA3B3], [M (AA)2 B2] प्रकार के यौगिक ज्यामितीय समावयतता दर्शाते है।
(ii) प्रकाशिक समावयवता (optical Isomerism):
दो या दो से अधिक ऐसे यौगिक जो समतल ध्रुवित प्रकाश को उनसे गुजारने पर प्रकाश को घुमा देते हैं, प्रकाशिक सक्रिय यौगिक कहलाते है, तथा उनका यह गुण प्रकाशिक समावयवता कहलाता है।
यौगिक प्रकाश को दो दिशाओ में घुमाते है:-
- (a) दक्षिणावर्त
- (b) वामावर्त
यदि यौगिक प्रकाश को दक्षिणावर्त दिशा मे घुमाए तो उसे (dextrorotary) d-form कहते है तथा जो योगिक प्रकाश को वामावर्त दिशा मे घुमाते है उसे (leavorotatory) l-form कहते हैं।
- (i) [M (AA)2 B2] => प्रकाशिक समावयवता दर्शाते है। उदा०→ [Co(en)2 Cl2 ] + => l&d form
- (ii) (M (AA)2BC] => प्रकाशिक समावयवता दर्शाते है।
- (iii) [M (AA)3] = > प्रकाशिक समावयवता दर्शाते है। उदा०→ [Co(en)3]
- (iv) [MA2B2C2] => प्रकाशिक समावयवता दर्शाते है। उदा –> [Co(NH3)2 Cl2 Br]-1
- (v) [MABCDEF]=> प्रकाशिक समावयवता दर्शाते हैं |
- उदा० => [pt (NH3) Cl.Br I Na Py]
बर्नर सिद्धांत [Verner’s Theory ] :
- सर्वप्रथम वर्नर ने उपसहसंयोजक यौगिको की संरचना के बारे में उपसहसंयोजक सिद्धांत प्रस्तुत किया जिसे वर्नर सिद्धांत कहते है।
- इस सिद्धांत के अनुसार, किसी भी केन्द्रीय धातु परमाणु की दो संयोजकताएं होती है जिसे सन्तुष्ट करने के लिए वह संकुल आयन का निर्माण करता है।
पराथमिक संयोजकता [Primary Valency]:- प्राथमिक संयोजकता धातु की ऑक्सीकरण संख्या के बराबर होती है तथा ऋणायनो द्वारा पूरी होती है। इसमे आयनिक बन्ध होते है अत: यह आयनीकृत होती है।
- यह अदिशात्मक होती है अत: संकुल की संरचना पर इनका कोई प्रभाव नही होता है।
- यह Dotted Line से दर्शायी जाती है।
द्वितीयक संयोजकता [Secondary Valency]:- यह उपसहसयोजन संख्या के बराबर होती है। यह सामान्यतः धनावेशित, ऋणावेशित य उदासीन लिगेण्डो से पूर्ण होती है। इसमें उपसहसंयोजक बन्ध पाए जाते हैं अत: यह आयनीकृत नहीं होती है।
- यह दिशात्मक होती है।
- यह पूर्ण तीर के द्वारा दर्शाते है।
संयोजी आबन्ध सिद्धांत (Valence Bond Theory):-
यह सिद्धांत मुख्य रूप से संकुल यौगिको की ज्यामिती तथा उनके चुम्बकीय गुणो की व्याख्या करता है।
इस सिद्धांत के कुछ बिन्दु निम्न है –
- केन्द्रीय धातु परमाणु अपनी आक्सीकरण संख्या के बराबर e– का त्याग करके धनायन बनाते है।
- केन्द्रीय धातु परमाणु लिगेण्ड से बन्ध बनाने के लिए अपनी उपसहसंयोजक संख्या के बराबर रिक्त कक्षक उपलब्ध करता है |
- यह रिक्त कक्षक आपस में संकरण करके समान संख्या में नए कक्षको का निर्माण करते हैं, जिनमे लिगेण्ड अपने e– युग्म दान करके उपसहसंयोजक यौगिक बनाता है।
- इस प्रकार से धातु के संकरित कक्षक व लिगेण्ड आपस में मिलकर यौगिक को एक निश्चित ज्यामिती प्रदान करते है।
- जिन संकुलो मे संकरण में आन्तरिक d- कक्षक भाग लेते है उन्हें अन्त: कक्षक संकुल या निम्न चक्रण संकुल कहते है। यह प्रक्रिया सामान्यतः प्रबल लिगेण्डो (CO, CN, NH3) की उपस्थिति में होता है
- वे यौगिक जिनमे संकरण मे बाह्य d-कक्षक भाग लेते हैं उन्हें बाह्य d-कक्षक संकुल या उच्च्च चक्रण संकुल कहते है। इस प्रक्रिया में दुर्बल लिगेणड भाग लेते हैं।
- यदि यौगिक के पास आयुग्मित e– युग्म होते है तो वह अनुचुम्बकीय होता है तथा सभी e– युग्मित होने पर यौगिक प्रतिचुम्बकीय होता है।
संयोजकता आबन्ध सिद्धांत की कमियां :-
- इस सिद्धांत से केन्द्रीय धातु परमाणु व लिगेण्ड के गुणो में परिवर्तन की सफल व्याख्या नही की जा सकी।
- यह सिद्धांत लिगेण्ड के कक्षको को महत्व नही देता है, इसमे केवल केन्द्रीय धातु के कक्षको को आधार बनाया जाता है।
- यह उपसहसंयोजक यौगिको के स्पेक्ट्रम की व्याख्या नही कर पाया।
- यह सिद्धांत आन्तरिक व वाहप कक्षक संकुल के बारे में कोई स्पष्ट वाख्या नहीं करता ।
क्रिस्टल क्षेत्र सिद्धांत (Crystal Field theory):
- इस सिद्धांत में धातु आयन तथा लिगेण्डों को बिन्दु आवेश मानते हुए वैधुत आकर्षण के सिद्धांत पर उपसहसंयोजक यौगिको की संरचना के बारे में बताया।
- जब लिगेण्ड केन्द्रीय धातु परमाणु की ओर यौगिक बनाने के लिए अग्रसर होते है तो लिगेण्ड के e– तथा धातु के d- कक्षक के e– के मध्य प्रतिकर्षण होता है, जिससे d-कक्षको की अपभ्रष्टता नष्ट हो जाती है और वह t2g तथा eg दो समूहो मे विभक्त हो जाते हैं। इससे ही क्रिस्टल क्षेत्र विघटन कहते है तथा दोनो समूहो की ऊजाओ के अन्तर को क्रिस्टल क्षेत्र विपाटन ऊर्जा कहते है।
अष्टफलकीय यौगिको में क्रिस्टल क्षेत्र विपाटन –
अष्टफलकीय यौगिको में लिगेण्ड धातु परमाणु की ओर अक्षो के समान्तर आते है अंत: वे कक्षक जो अक्षो के समात्तर होते हैं, ज्यादा प्रतिकर्षण का अनुभव करते है तथा अक्षो के कोने पर उपस्थित कक्षक कम प्रतिकर्षण का अनुभव करते हैं। अत: अक्षीय कक्षको की ऊर्जा अधिक हो जाती है एवं निरक्षीप कक्षको की ऊर्जा कम होती है।
कक्षक में इलेक्ट्रान भरने के नियम:-
- (i) प्रबल लिगेण्ड की उपस्थिति में – युग्मन ऊर्जा (π) < विपाटन ऊर्जा (△0) इस स्थिति में पहले t2g कक्षक पूर्ण रूप से जाते हैं फिर शेष e– eg कक्षक में जाते है।
- (ii) दुर्बल लिगेण्ड की उपस्थिति में – युग्मन ऊर्जा (π) > विपाटन ऊर्जा (△0) इस स्थिति में पहले सभी कक्षको में एक-एक e– भरे जाते है फिर उन्हें युग्मित करते है।
चतुष्फलकीय यौगिको मे क्रिस्टल क्षेत्र विपाटन :
चतुष्फलकीय यौगिको में लिगेण्ड धातु परमाणु की ओर अक्षो के बीच से आते है जिससे अक्षो के बीच उपस्थित t2g कक्षक ज्यादा प्रतिकर्षण का अनुभव करते है तथा अक्षीय कक्षक (eg) कम प्रतिकर्षण अनुभव करते है। अत: t2g कक्षको की ऊर्जा अधिक तथा eg कक्षको की ऊर्जा कम हो जाती है।
क्रिस्टल क्षेत्र सिद्धांत की सीमाए:-
क्रिस्टल क्षेत्र मॉडल के द्वारा उपसहसंयोजक यौगिको के बनने उनकी संरचना, रंग तथा चुम्बकीय गुण की सफलतापूर्वक व्याख्या की जा सकती है, परन्तु यह सिद्धांत कक्षको के विपाटन का जो आधार देता है, उसके अनुसार ऋणावेशित लिगण्डो द्वारा सर्वाधिक विपाटन होना चाहिए किन्तु ऐसा नहीं है, जिसकी यह व्याख्या नहीं कर सका।
इस सिद्धांत मे धातु व लिगेण्ड के मध्य बने बन्ध को पूर्णतः आयनिक माना गया है तथा उनके मध्य उपसहसंयोजक बच्ध की कोई व्याख्या नहीं की गई है।
स्पेक्ट्रमी रासायनिक श्रेणी (लिगेण्डो की प्रबलता का क्रम) :-
जब लिगेण्डों को उनकी प्रबलता के बढ़ते क्रम में व्यवस्थित किया जाता है तो प्राप्त श्रेणी को स्पेक्ट्मी रासायनिक श्रेणी कहते है।
उपसहसंयोजक यौगिको मे रंगो की व्याख्या:- जब t2g कक्षक मे उपस्थित e– श्वेत दृश्य प्रकाश से ऊर्जा अवशोषित करता है तो यह eg कक्षक में प्रवेश कर जाता है। इसे d-d संक्रमण कहते है तथा शेष बचा हुआ प्रकाश अश्वेत नही होता जिससे यौगिक का रंग दिखायी देता है।
धातु का आयन रंगीन तभी होता है जबकि उनके पास लिगण्ड उपस्थित होते है। लिगण्ड की अनुपस्थिति में पदार्थ रंगहीन होता है।
संकुल के रंग को प्रभावित करने वाले कारक:-
- (i) लिगेण्ड की प्रकृति:- एक धातु आयन अलग -अलग लिगेण्डो के साथ अलग-अलग रंग दर्शाता है।
- (ii) संकुल की ज्यामिती: संकुल की ज्यामिती बदलने पर रंग बदल
धातु कार्बोनिल में बन्ध :-
- होमोलेप्टिक कार्बोनिल यौगिक जिनमें केवल कार्बोनिल लिगेण्ड होते है, अधिकतर संक्रमण धातुओ द्वारा निर्मित होते हैं।
- इन कार्बोनिल की संरचना सरल तथा सुस्पष्ट होती है।
- ट्रेटार्कोनिलनिकिल (O) चतुष्फलकीय , पेंटाकार्बोनिल आयरन(O) त्रिकोणीय द्विपिरैमिडी है जबकि हेक्साकार्बोनिलक्रामियम(O) अष्टफलकीय है।
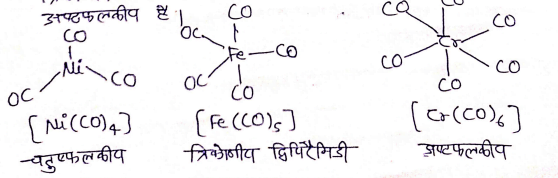
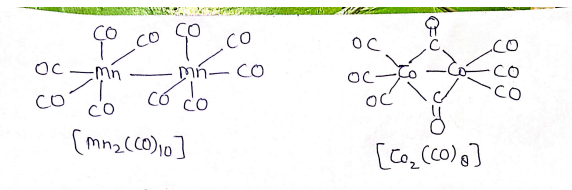
धातु कार्बोनिल के धातु- कार्बन आबन्ध मे न तथा π दोनो के गुण पाये जाते है
उपसहसंयोजक यौगिको का महत्व:- ये यौगिक खनिजों, पेड़ पौधो, व जीव जगत मे व्यापक रूप में पाये जाते हैं तथा विश्लेषणात्मक रसायन, धातुकर्म जैविक प्रणालियो उद्योगो तथा औषध के क्षेत्र में इनकी महत्वपूर्ण भूमिकाएं है।
- जल की कठोरता का आंकलन Na2EDTA के साथ अनुआपन द्वारा किया जाता है।
- धातुओ की कुछ प्रमुख निष्कर्षण विधियो में जैसे सिल्वर तथा गोल्ड के लिए संकुल विरचन का उपयोग होता है।
- इसी प्रकार धातुओ के शुद्धीकरण उनके संकुल बनाकर तथा उसे पुनः विघटित करके किया जाता है
- चिरसम्मत तथा यांत्रिक विधियो द्वारा धातु आयन की पहचान व उनके मात्रात्मक आंकलन में किया जाता है।
- उपसहसंयोजक यौगिक जैव तंत्र में बहुत ही महत्वपूर्ण है। प्रकाश संश्लेषण के लिए उत्तरदायी वर्षक क्लोरोफिल, मैग्नीशियम का उपसहसंयोजक यौगिक है।
Chapter 4 – d एवं f ब्लॉक के तत्व
Chapter 6 – हैलोएल्केन और हैलोएरीन नोट्स
Tagged with: Chemistry chapter 5 class 12 notes in hindi | Chemistry class 12 chapter 5 in hindi notes | Chemistry class 12 chapter 5 notes in hindi | class 12 Chemistry chapter 5 ncert notes in hindi | Class 12 Chemistry Chapter 5 Notes in Hindi | Coordination compound notes in hindi

Please give me notes pdf chemistry
Please find class 12 chemistry pdf notes. https://readaxis.com/class-12-chemistry-handwritten-notes-in-hindi-pdf-download/