यहाँ हमने Class 12 Chemistry Chapter P- ब्लॉक के तत्त्व Notes दिये है। Class 12 Chemistry Chapter P- ब्लॉक के तत्त्व Notes आपको अध्याय को बेहतर ढंग से समझने में मदद करेंगे और आपकी परीक्षा की तैयारी में सहायक होंगे।
Class 12 Chemistry Chapter P- ब्लॉक के तत्त्व Notes
- ऐसे तत्व जिनका अन्तिम e– p-कक्षक में प्रवेश करता है, p- ब्लाक तत्व कहलाते है।
- इनके बाह्यतम कोश का सामान्य e– विन्यास ns2, np1-6 होता है।
- आवर्त सारणी में इनको IIIA, IVA, VA, VIA, VIIA, तथा शून्य समूह में रखा गया है।
बोरॉन परिवार [ समूह 13] [IIIA]
आवर्त सारनी में IIIA समूह में 5 तत्व B, Al, Ga, In, Tl में रखे गये है।
इनका सामान्य e– विन्यास ns2, np1 होता है। अत: इन्हें आवर्त सारणी में IIIA समूह में रखना उचित है।
बोरॉन परिवार के सामान्य लक्षण
- e– विन्यास – इनका सामान्य e– विन्यास ns2 , np1एक समान होता है |
- संयोजकता एवं आक्सीकरण संख्या – इनकी संयोजकता 3 तथा आक्सीकरण अवस्था +3 होती है।
- परमाणु त्रिज्या – इनकी परमाणु त्रिज्या कम होती है, जो ऊपर से नीचे आने पर बढ़ती है। B<Ga<Al<In<Tl
- आयनन विभव – इनके आयनन विभव कम होते है।
- विद्युत ऋणात्मकता – इनकी विद्युत ऋटनात्मकता कम होती है। B>Tl>Al>In>Ga>Al
बोरॉन (B)
प्रकृति में बोरॉन निम्न रूपों में पाया जाता है –
- बोरिक एसिड (H3BO3)
- कोली मैग्नाइट या कौल मैग्नाइट [Ca2B6O11.5H2O]
- बोरेक्स (सुहागा] [Na2 B4O7. 10H2O]
बोरिक एसिड या आर्थो एसिड (M3BO3) या B (OH)3 बनाने की विधिया –
(i). बोरेक्स के सान्द्र जलीय विलयन में जल मिलाकर H2SO4 के साथ गर्म करने पर H3BO3 प्राप्त होता है:-

(ii) कोली मैग्नाइट के जलीप गर्म विलयन में SO2 प्रवाहित करने पर H3BO3 प्राप्त होता है।

भौतिक गुण –
- यह सफेद रंग का पारदर्शी पदार्थ है।
- यह जल में अल्प विलेय है।
रासायनिक गुण :
(I) ताप का प्रभाव – गर्म करने पर यह अपघटित होकर निम्न यौगिक बनाता है।

(2) NaOH से क्रिया – H3BO3, NaOH से क्रिया करके सोडियम मेटा बोरेट बनाता है।
H3BO3 +NaOH → NaBO2 +H2O
उपयोग-
- पूर्तिरोधी के रूप में।
- खाने की वस्तुओं के संरक्षण में ।
- आँखो की दवा के निर्माण में।
- कांच के बर्तन के निर्माण में ।
(2) बोरेक्स (सुहागा) (Na2B4O7 .10H2O)
बनाने की विधियां –
(1) सोडियम मेटा बोरेट पर CO2 की क्रिया द्वारा:- सोडियम मेटा बोरेट पर C02 की क्रिया कराने पर बोरेक्स प्राप्त होता है।
4 NaBO2 +C02 → Na2B4O7+ Na2CO3
(2)बोरिक एसिड से:- बोरिक एसिड से Na2CO3 की क्रिया कराने पर बोरेक्स प्राप्त होता है।
भौतिक गुण:-
- यह सफेद रंग का क्रिस्टलीय ठोस पदार्थ है।
- यह गर्म जल में विलेय है।
रासायनिक गुण:-
(1) जल से क्रिया:- बोरेक्स की क्रिया जल से कराने पर बोरिक एसिड प्राप्त होता है।
Na2B4O7 + 7H2O → 4H3BO3+ 2NaOH
(2) ताप का प्रभाव:- गर्म करने पर यह जल अपघटित हो जाता है एवं तेज गर्म करने पर सोडियम मेटा बोरेट तथा B2O7 का सफेद पारदर्शक पदार्थ प्राप्त होता है। इसे सुहागा गनका परीक्षण कहते है।

उपयोग:-
- खाध पदार्थ के संरक्षण में।
- गुनात्मक विश्लेषण में ।
- कागज व बर्तन उद्योग में।
- कांच व साबुन उद्योग में ।
बोरॉन के हाइड्राइड:-
बोरॉन हाइड्रोजन के साथ अनेक सह संयोजी हाइड्राइड बनाता है। इनका सामान्य सूत्र BnHn+4 तथा BnHn+6 होता है |
e.g:- B2H6, B4H10
कार्बन परिवार (GROUP 14) IVA
- आवर्ती सारणी के IVA समूह में पांच तत्व C, Si, Ge, Sn ,Pb को रखा गया है । इन तत्वो को कार्बन परिवार कहते है।
- इन तत्वों के बाह्यतम कोश का समान e– विन्यास ns2 np2 एक समान होता है। इसीलिए इन्हे आवर्त तत्वों के IVA में रखा गया है।
कार्बन परिवार के सामान्य लक्षण :-
- e– विन्यास – इन तत्वों का सामान्य e– विन्यास ns2 np6 होता है।
- परमाणु त्रिज्या – इनकी परमाणु त्रिज्या ऊपर से नीचे जाने पर बढ़ती है।
- संयोजकता – इनकी संयोजकता 4 होती है।
- आक्सीकरण अवस्था – इन तत्वों की आक्सीकरण अवस्था +2 तथा +4 होती है।
- अपररूपता – Pb को छोड़कर सभी तत्व अपररूप प्रदर्शित करते हैं।
कार्बन
- प्रकृति में कार्बन मात्रा में सिलिकान (Si) के साथ बहुत अधिक पाया जाता है।
- यह मुक्त अवस्था जैसे- कोयला, हीरा, ग्रेफाइट तथा संयुक्त अवस्था में यह कार्बोनेट, CO, पेट्रोल इत्यादि अवस्था में पाया जाता है।
अपररूपता: जब कोई तत्व दो या दो से अधिक रूपों में पाया जाता है तथा उनके भौतिक गुणों में भिन्नता पाई जाती है परन्तु रासायनिक गुणो मे समानता पाई जाती है। ऐसे तत्व एक दूसरे के अपररूप तथा इस गुण को अपररूपता कहते है।
कार्बन के अपररूप:-
कार्बन क्रिस्टलीय तथा अक्रिस्टलीय दो रूपो मे पाया जाता है।
- क्रिस्टलीप अपररूप:- कार्बन क़े मुख्य क्रिस्टलीय अपररूप हीटा , ग्रेफाइट व फुलैरीन है।
- अक्रिस्टलीय अपररूप:- इसमें मुख्य रूप से कोक, कोल, चारकोल, कास्ट चारकोल, जन्तु काजल इत्यादि है।
क्रिस्टलीय अपररूप –
1. हीरा (डायमण्ड):- हीरा कार्बन का सबसे शुद्ध रूप है। यह सबसे कठोर पदार्थ है। इसका गलनांक 3727°C होता है। परन्तु यह विद्युत व ऊष्मा का कुचालक है। हीरे मे प्रत्येक कार्बन परमाणु Sp3 संकरित होत है एवं प्रत्येक कार्बन C-C बन्ध की लम्बाई 1.54Ao होती है। इसमें प्रत्येक कार्बन परमाणु अन्य 4 परमाणुओ के साथ त्रिविमीय अवस्था में जुड़े होते हैं।
इसका उपयोग कांच को काटने, चट्टानो को काटने, औजार बनाने में, टंगस्टन तार बनाने मे होता है।
2. ग्रेफाइट:- यह द्विविमीय परत संरचना के रूप में पाया जाता है। इसमे परते दुर्बल वान्डरवाल बल द्वारा जुड़ी रहती है। इसीलिए ग्रेफाइट नर्म व मुलायम होती है। इन परतो के बीच की दूरी 3.40Ao तथा प्रत्येक c-c बन्ध की लम्बाई 1.42Ao होती है। इसमें प्रत्येक परमाणु sp2 संकरित होता है। जिससे π बन्ध बनता है। ये e– परतो में विस्थानीयकृत होते है। यही कारण है कि ग्रेफाइट विद्युत का सुचालक होता है।
उपयोग:-
- (I) नाभिकीय रिएक्टर में मन्दक के रूप में।
- (II) पेन्सिल बनाने में ।
- (III) सेलो के इलेक्ट्रोड बनाने में।
note:- जब ग्रेफाइट को 3000k ताप तथा 125 k bar दाब पर गर्म करते है तो यह हीरे में बदल जाता है।
हीरा तथा पर ग्रेफाइट में अंतर हीरा –
| हीरा | ग्रेफाइट |
|---|---|
| इसमे कार्बन परमाणु sp3 संकरित होता है। | इसने कार्बन परमाणु sp2 संकरित होता है। |
| यह विद्युत का कुचालक होता है। | यह विद्युत का कुचालक होता है। |
| यह एक कठोर पदार्थ है। | यह मुलायम तथा चिकना पदार्थ है। |
| यह पारदर्शी होता है। | यह अपारदर्शी एवं काला होता है। |
| इसका गलनांक बहुत उच्च होता है। | इसका गुल्मांक बहुत कम होता है। |
(c) फुलरीन : यह भी कार्बन का अपरूप है। जो क्रिस्टलीय अवस्था में पाया जाता है| इसके एक अणु में 60-70 या इससे अधिक मात्रा में कार्बन होते हैं।
- जब He, Ar इत्यादि अक्रिय गैसो की उपस्थिति में ग्रेफाइट को विद्युत आर्क में गर्म किया जाता है तो फुलरीन का निर्माण होता है। इसकी संरचना फुटबाल के समान होती है |
- इसकी सबसे सामान्य संरचना c-60 है। इसे आर्केटिक वकमिन्स्टर फुलरीन के नाम पर फुलरीन कहते हैं।
- C-60 अणु मे 12 पांच सदस्यीय तथा 26 तथा 26 छ: सदस्यीय रिंग होती है तथा प्रत्येक कार्बन परमाणु sp2 संकरित होता है।
(ii) कार्बन के अक्रिस्टलीय अपररूप –
इसकी संरचना फुटबाल
- (a) कोक: यह काले रंग का ठोस पदार्थ होता है जो कोयले के भंजक आसवन से प्राप्त होता है।
- इसमें कार्बन की मात्रा 85-90% होती है l
- (b) कोल (कोयला):- यह एक प्राकृतिक उत्पाद है जो कार्बोनीकरण द्वारा प्राप्त होता है।
- यह विभिन्न रूपो में पाया जाता है, जिसमे कार्बन की मात्रा भिन्न-भिन्न होती है।
- उदा० : पीट -60%C, लिग्नाइट – 77%C , बिटुमनी – 80%C तथा एन्था सीन – 90%C
- (c) चारकोल :– यह कार्बन का अशुद्ध रूप है। इसे लकड़ी अस्थि तथा रक्त के द्वारा शुद्ध किया जाता है| ये निम्न प्रकार के होते है:- (i) जन्तु चारकोल (ii) काष्ठ चारकोल (iii) शर्करा चारकोल
- (d) गैस कार्बन:- कोयले के भंजक आसवन से रिटार्ट के ऊपर जमा पदार्थ होता है: यह विद्युत का सुचालक होता है। इसका प्रयोग इलेक्टॉड बनाने मे किया जाता है है।
सिलकेट
- वे यौगिक सिलकेट इकाई Sio4 4- पायी जाती है, सिलिकेट कहलाते है। ये सैलिसिलिक अम्ल के धात्विक व्युत्पन्न होते है।
- इनकी मूल संरचना में सिलिकेट इकाई होती है, इनकी संरचना समचतुष्फलकीय होती है ये सभी प्रकार की चट्टानो मिट्टी तथा रेत के मुख्य घटक है।
जियोलाइट
जब सिलिकॉन डाई आक्साइड के त्रिविमीय जालक में से कुछ Si परमाणुओं को Ar द्वारा प्रतिस्थापित करते है तो प्राप्त संरचना को एलुमिनो सिलिकेट कहते है। जिस पर इकाई ऋटणावेश होता है। इसे धनायन [Na+, k+, Ca2+] द्वारा संतुलित करते है । इसे जियोलाइट कहते है।
उपयोग –
- (I) जल की कठोरता दूर करने मे।
- (II) पेट्रोलियम उद्योग में उत्प्रेरक के रूप मे।
सिलिकॉन्स
सिलिकॉस संश्लेषित – कार्बन सिलिकॉन के बहुलक होते है। इनमें R2SiO इकाई एक दूसरे से Si-O-Si बन्ध द्वारा जुड़ी रहती है। सिलिकॉस का सामान्य सूत्र → [R2SiO]nहोता है।
गुण:-
- (I) ये रासायनिक दृष्टि से अक्रिय होते है।
- (II) इनमे ताप परिवर्तन का कोई प्रभाव नहीं पड़ता।
- (III) इनमे जल प्रतिकर्ष क्षमता होती है।
उपयोग –
- (I) विद्युत कुचालक के रूप में।
- (II) स्नेहक के रूप में।
- (III) जलरोधी पेन्ट बनाने में
सिलिकॉन का निर्माण – ड़ाई एल्किल डाई क्लोरो सिलिकेन के जल अपघटन के पश्चात बहुलीकरण पर सिलिकॉन प्राप्त होती है

सिलिकॉन ट्रेटा क्लोराइड [SiCl4]
इसे ट्रेटा क्लोरो सिलिकेन भी कहते हैं।
बनाने की विधियां: –
[1] प्रयोगशाला विधि : Si को Cl2 के साथ गर्ग करने पर SiCl4 प्राप्त होता है।
![Class 12 Chemistry Chapter P- ब्लॉक के तत्त्व Notes in Hindi 6 सिलिकॉन ट्रेटा क्लोराइड [SiCl4]](https://readaxis.com/wp-content/uploads/2023/03/image-79.png)
[2] कार्बन तथा SiCl2 के मिश्रण को क्लोटीन के साथ गर्ग करने पर –
![Class 12 Chemistry Chapter P- ब्लॉक के तत्त्व Notes in Hindi 7 सिलिकॉन ट्रेटा क्लोराइड [SiCl4]](https://readaxis.com/wp-content/uploads/2023/03/image-80.png)
भौतिक गुण :
- (i) यह एक रंगहीन वाप्पशील द्रव हैं जो वायु में धुआँ उत्पन्न करता है।
- (ii) यह जल अपघटित हो जाता है।
उपयोग:-
- सिलिकॉन के निर्माण में।
- सिलिका के उत्पादन में ।
Note- श्रृंखलन:- कार्बन के परमाणु परस्पर एकल द्वि या त्रिबन्ध द्वारा संयुक्त होकर खुली एवं बन्द श्रृंखलाओ का निर्माण करते है। कार्बन के इस विशेष गुण को श्रृंखलन कहते है । यह गुण सबसे अधिक कार्बन में पाया जाता है।
नाइट्रोजन परिवार (समूह 15) या VA
आवर्त सारणी के VA समूह में 5 तत्व N, P, As, Sb, Bi रखे गये है। इन तत्वो को N परिवार कहा जाता है।
इस वर्ग का पहला तत्व N है जो अन्य तत्वो की प्रतिनिधित्व करता है। ये तत्व निकोजन भी कहलाते है तथा इनके यौगिक निकोटाइड्स कहलाते है।
उपलब्धता:
- N(नाइट्रोजन) → वायुमण्डल में आण्विक N2 का 70% होता है।
- फॉस्फोरस – ऐपेटाइड के खनिजो [Ca3(PO4)6CF2] फ्लओरा ऐपेटाइड प्राणियो एवं पादयों के पदार्थ का अवयव के रूप में | दूध एवं अंडो में।
- As, Sb, Bi → सल्फाइड खनिजो के रूप में।
नाइट्रोजन परिवार के प्रमुख लक्षण:-
e– विश्वास:- इनका सामान्य e– विश्वास ns2, np3 होता है।
भौतिक अवस्था:-
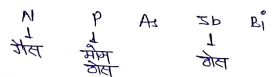
- परमाणु एवं आयनिक त्रिज्या:- इन तत्वों की परमाणु त्रिज्या ऊपर से नीचे जाने पर बढ़ती है।
- N<P<As<Sb<Bi
- इलेक्ट्रान बंधुता:- सामान्यतः वर्ग में ऊपर से नीचे जाने पर घटती है।
- P>N> As>Sb>Bi
- धात्विक लक्षण:- वर्ग में ऊपर से नीचे जाने पर धातिक लक्षण बढ़ता है।
- N<P<As<Sb<Bi
- क्वथनांक एवं गलनांक:-
- (B.P) क्वथनांक → N2< P4< As4< Bi2< Sb4
- (M.P) गलनांक → N2< P4< Bi2< Sb4< As4
- श्रृंखलन:- इस वर्ग के सभी तत्व इस गुण को प्रदर्शित करते है लेकिन C से कम ।
- अपररूपता:- Sb व Bi को छोड़कर सभी तत्व अंपररूप दर्शाते है।
- आक्सीकरण अवस्था:- N को छोड़कर सभी तत्व +3, +5 आक्सीकरण अवस्था प्रदर्शित करते है।
- आयनन विभव:- इनके आयनन विभव उच्च होते हैं। वर्ग में ऊपर से नीचे जाने पर घटते है।
रासायनिक गुण
N2 मे त्रिक संघ की उपस्थिति के कारण इसकी आबंध ऊर्जा अधिक होती है। अतः यह सामान्य ताप पर बहुत कम क्रियाशील है।
(1) हाइड्रोजन के प्रति अभिक्रियाशीलता:- इस वर्ग के तत्व EH3 प्रकार के हाइड्राइड बनाते है। [E = N, P, As, Sb, Bi]

संरचना:- पिरामिडी
आबंध कोण:-

क्षारीय प्रवृति:-

N2 के अन्य दो हाइड्राइड:- N2H4 [हाइड्रोजन] , N3H [हाइड्रोजोइक अम्ल]
(2) आक्सीजन के प्रति अभिक्रियाशीलता:- इस वर्ग के तत्व दो प्रकार के आक्साइड बनाते है E2O3 तथा E2O5 |
(3) हैलोजन के प्रति क्रियाशीलता:- ये दो प्रकार हैलाइड बनाते है।
(i) ट्राई हैलाइड [EX3] (11)पेन्टा हैलाइड [EX5]
- N केवल ट्राइहैलाइड बना सकती है क्योंकि इसके पास d – कक्षक नहीं होते है।
- N का केवल एक हैलाइड हैलाइड NF3 स्थायी होता है। BiF3 आयनिक होता है तथा अन्य सभी हैलाइड सहसंयोजक यौगिक है।
आक्सी अम्ल
अम्लीयता:- HNO3 >7 H3P04 >H3 As04> H3Sb04> H3 Bi04
धातुओ के प्रति क्रियाशीलता:- ये सभी तत्व धातुओं के साथ क्रिया करके द्विआगी यौगिक बनाते है।
N2 [ नाइट्रोजन के असामान्य गुण]:- N अपने वर्ग के अन्य तत्वो से असामान्य व्यवहार दर्शाता है। जो निम्न है. –
- (a) छोटा आकार
- (b) उच्च विद्युत ऋणात्मकता
- (C) उच्च आयनन एंथैलीपी
- (d) d-d कक्षको की अनुपस्थिति
नाइट्रोजन
नाइट्रोजन समूह 15 का प्रथम तत्व है। वायु में लगभग 70% मात्रा पायी जाती है। यह द्विपरमाण्विक अणु के रूप में होती है।
N2 निर्माण की विधियां
[1] औद्योगिक उत्पादन:- इसका औद्योगिक उत्पादन वायु के द्रवण तथा प्रभाजी आसवन से करते है। पहले द्रव N2 [77.2K] पर आसवित होती है तथा O2 शेष रह जाती है।
[2] प्रयोगशाला विधि:- प्रयोगशाला में N2 को सोडियम नाइट्राइट तथा अमोनियम क्लोराइड के सान्द्र विलयन को गर्म करके बनाया जाता है।
[3] अमोनियम ईक्रोमेट को गर्म करके भी जाइड्रोजन को बनाया जाता है।
भौतिक गुण :
- N2 रंगहीन, गंदहीन, स्वादहीन व अविषैली गैस है।
- इसकी जल में विलेयता बहुत कम है।
- यह वायु से थोड़ा हल्की होती है।
रासायनिक गुण:-
[i] धातु से क्रिया:- उच्च ताप पर यह धातु से क्रिया करके धतिव्क नाइट्राइड बनाती है।

[ii] आक्सीजन से क्रिया:-

N2 के उपयोग:-
- N2 मुख्यतः NH3 तथा N – युक्त यौगिको के निर्माण में प्रयुक्त होता है।
- N2 का उपयोग अक्रिय वातावरण उत्पन्न करने में होता है।
- द्रव N2 का उपयोग जैविक पदार्थो एवं बाघ सामाग्री के प्रतीशीतक के रूप में होता है।
नाइट्रोजन के यौगिक
(i) अमोनिया [NH3]
- अणुसूत्र = NH3
- अणुभार =17
संरचना सूत्र =

निर्माण की विधियां –
[i] प्रयोगशाला विधि:- अमोनियम क्लोराइड (नौसादर) को बुझे चूने के साथ गर्म करने पर NH3 प्राप्त होती है।

[ii] अमोनियम सल्फेट को गर्म करने पर –

[iii] औद्योगिक विधि –
हैबर विधि – इस विधि में N2 तथा H2, Fe/Mo की उपस्थिति में उच्च ताप व दाब पर संयुक्त होकर अमोनिया बनाती है।

यह एक ऊष्माक्षेपी अभिक्रिया है ।
गुणधर्म :-
भौतिक गुण:-
- यह रंगहीन तीक्ष्न गंघ वाली गैस है|
- इसे सूँघने पर बेहोशी आ जाती है।
- यह जल में घुलनशील है।
रासायनिक गुण :-
(i) क्लोरीन से क्रिया:- (a) जब अमोनिया का अधिक्य Cl2 कि कम मात्रा सें अभिक्रिया करता है , तो N2 गैस बनती है।
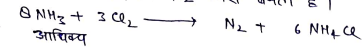
(b) परन्तु जब Cl2 आधिक्य NH3 की कम मात्रा से अभिक्रिया करता है तो नाइट्रोजन ट्राईक्लोराइड जैसा विस्फोटक उत्पाद बनता है।

(ii) अपचायक प्रकृति:- अमोनिया , भारी धातु आवसाइडो को संगत धातु में अपचयित कर देती है।

(iii) सिल्वर क्लोराइड पर अमोनिया की अभिक्रिया:- जब सिल्वर क्लोराइड से अमोनिया की अभिक्रिया होती है, तब डाईएमीनो सिल्वर (I) लवण बनता है।

उपयोग :-
- (I) द्रव अमोनिया प्रशीतक के रूप में ।
- (II) अमोनिया का उपयोग कपड़ो से ग्रीस, चिकनाई, धब्बे आदि हटाने मे होता है।
- (III) यूरिया के निर्माण में।
- (IV) प्रयोगशाला में अभिकर्मक के रूप में
[ii] नाइट्रिक अम्ल [HNO3]
बनाने की विधियां:-
[1] प्रयोगशाला विधि:- प्रयोगशाला में सोडियम या पोटैशियम नाइट्रेट को Conn H2 S04 के साथ कांच के रिटार्ट में गर्म करने पर HNO3 प्राप्त होता है।

(2) औद्योगिक विधि:-
- (i) ओस्टवाल्ड विधि
- (ii) बर्कलैण्ड या आर्क विधि
(i) ओस्टवाल्ड विधि:- ओस्टवाल्ड विधि में प्लेटिनम उत्प्रेरक की उपस्थिति में 700 से 800०C पर अमोनिया का वायु द्वारा नाइट्रिक ऑक्साइड में आक्सीकरण कराया जाता है।

नाइट्रिक आक्साइड (NO) का वायु की आक्सीजन द्वारा नाइट्रोजन डाई आक्साइड में ऑक्सीकरण करके इसके जल में अवशोषित करने पर तनु नाइट्रिक अम्ल प्राप्त होता है।

अम्लराज:- 1 भाग नाइट्रिक अम्ल और 3 भाग HCl को परस्पर मिलाकर अम्लराज [ऐक्वारेजिया] बनाया जाता है।

[ii] बर्कलैण्ड या आर्क विधि:- जब वायु को विद्युत आर्क मे प्रवाहित किया जाता है तो वायु की N तथा O2 संयुक्त होकर निम्न अभिक्रियाएं होती है जिससे HNO3 बनता है।

भौतिक गुण:-
- (I) यह एक रंगहीन तीक्ष्न गंध वाला द्रव है।
- (II) यह जल में घुलनशील है।
- (III) इसका क्वथनांक 1200C होता है।
रासायनिक गुण:-
(i) ताप का प्रभाव:- यह गर्म करने पर NO2, O2 तथा H2O में टूट जाता है।

(ii) अधातुओ से क्रिया:-
(a) सल्फर से क्रिया – H2SO4 प्राप्त होता है।
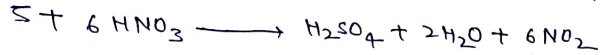
(b) सफेद या पीले फास्फोरस से क्रिया – H3 PO4 बनता है।

(c) कार्बन से क्रिया- CO2 प्राप्त होता है।

(d) आयोडीन से क्रिया – पर आयोडिक अम्ल बनता है।

(e) KI से क्रिया – आयोडीन व पोटैशियम नाइट्रेट प्राप्त होता है।

(iii) धातुओ से क्रिया
a) टिन से क्रिया:- अमोनियम नाइट्रेट तथा स्टेनस नाइट्रेट बनता है।

(b) Fe से क्रिया:-
(i) ठण्डे व तनु HNO3 से क्रिया –

(ii) ठण्डे व सान्द्र HND3 से क्रिया –

उपयोग:-
- (i) विस्फोटक बनाने में ।
- (ii) उर्वरक बनाने में
- (iii) औषधियां बनाने में।
फास्फोरस [P]
परमाणु क्रमांक =15 , परमाणु भार =15
फास्फोरस के अपररूप
- सफेद फास्फोरस या पीला फास्फोरस
- लाल फास्फोरस
- काला फास्फोरस
- α – काला फास्फोरस
- β- काला फास्फोरस
(i) सफेद फास्फोरस:- फास्फोरस वाष्पो को शीघ्रता से ठण्डा करने प्राप्त P को सफेद फास्फोरस कहते हैं
सफेद फास्फोरस की संरचना

भौतिक गुण:-
- (i) यह शुद्ध अवस्था में सफेद रंग का होता है।
- (ii) यह मोम जैसा अन्य पारदर्शी ठोस पदार्थ है।
- (iii) इसमे लहसुन जैसी गंध आती है।
- (iv) इसकी वाष्प जहरीली होती है।
- (v) यह धूप में बने पर पीला पड़ जाता है।
रासायनिक गुण:- (a) Cl2 से क्रिया – PCl3 व PCl5 बनाता है।

(b) H2 से क्रिया – फास्फीन बनाता है।
P4+ 6H2 -> 4PH3
(c) अम्लो से क्रिया – आर्थो फास्फोरिक अम्ल प्राप्त होता है।

उपयोग:-
- (i) माचिश बनाने में
- (ii) चूहा गारने की दवा बनाने में
- (iii) आतिशबाजी बनाने में ।
[ii] लाल फास्फोरस:-
भौतिक गुण:-
- (I) यह लाल रंग का गन्दहीन क्रिस्टल चूर्ण है |
- (II) साधारण ताप पर काफी स्थापी होता है |
- (III) यह अविषैला होता है।
- (IV) इसके विलयन का रंग लाल होता है।
संरचना –

रासायनिक गुण:-
(a) दहन:-

(b) सल्फर से क्रिया:-

(iii) काला फास्फोरस:- ये दो प्रकार के होते है
(I)α – काला फास्फोरस
(II) β- काला फास्फोरस
निर्माण:- सफेद फास्फोरस को 200 °C ताप तथा उच्च दाब पर गर्म करने पर काला फास्फोरस प्राप्त होते है |

संरचना –

फॉस्फोरस के यौगिक
(1) फास्फीन (PH3)
बनाने की विधियां –(a) फास्फाइको की जल क्रिया द्वारा
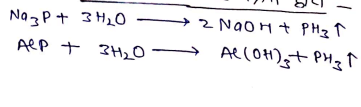
(b) फास्फोरस अम्ल को गर्म करने पर:- फास्फोरिक अम्ल व फास्फीन प्राप्त होती है।
(c) प्रयोगशाला विधि:- सफेद फास्फोरस को अक्रिय वातावरण में NaOH के सान्द्र विलयन के साथ गर्म करने फास्फीन गैस प्राप्त होती है।
भौतिक गुण:-
- (I) यह एक रंगहीन, सँड़ी मछली जैसी गंध वाली गैस है।
- (II) इसे सूघने पर सिरदर्द होने लगता है।
- (III) यह जल में अन्य विलेय है।
रासायनिक गुण
(i) जल से क्रिया – पहले P2O5 बनता है जो पुन: ऑर्थों फास्फोरिक अम्ल देता है।

(ii) क्लोरीन से क्रिया

(iii) CuSO4 से क्रिया:- काले रंग का क्यूनिक फाल्फाइड देता है।

(iv) HNO3 से क्रिया – P2 O5 बनता है।

(v) Ag NO3 से क्रिया- रजत दर्पण बनता है।

उपयोग-
- (I) होम्ज संकेत में’ [Ca3P2, CaC2]
- (II) चूहा मारने की दवा बनाने में।
- (III) रजत दर्पन बनाने में ।
(2) फॉस्फोरस ट्राई क्लोराइड [PCl3]
बनाने की विधि –
सफेद फॉस्फोटल पर शुष्क क्लोरीन की क्रिया द्वारा PCl3 प्राप्त होता है।
![Class 12 Chemistry Chapter P- ब्लॉक के तत्त्व Notes in Hindi 50 फॉस्फोरस ट्राई क्लोराइड [PCl3]](https://readaxis.com/wp-content/uploads/2023/03/image-138.png)
भौतिक गुण –
- (I) यह एक रंगहीन द्रव है ।
- (II) यह जल में घुलनशील है।
रासायनिक गुण –
(i) जल से क्रिया – फास्फोरस अम्ल तथा HCl प्राप्त होता है।

(ii) Cl2 से क्रिया – PQ5 बनता है।

(3) फास्फोरस पेन्टा क्लोराइड (PCl5)
बनाने की विधि – (ii) सफेद फास्फोरस की क्रिया सल्फोरिल क्लोराइड से कराने पर |

(ii) प्रयोगशाला विधि – PCl3 को Cl2 के साथ गर्ग करने पर PCl5 बनता है।

भौतिक गुण:-
- (I) यह एक रंगहीन ठोस पदार्थ है।
- (II) यह उच्च दाल पर पिघल जाता है।
रासायनिक गुण –
(1) जल से क्रिया – पहले POCl3 बनता है जो जल की अधिकता में फास्फोरिक अम्ल देता है।

फॉस्फोरस के ऑक्सी अम्ल
- (1) H3 PO2 [ हाइपो फास्फोरस अम्ल ]
- (2) H3 PO3 [ऑर्थो फास्फोरस अम्ल ]
- (3) H3 PO4 [ आर्थो कास्फोरिक अम्ल]
- (4) H4 P205 [पाइरो फास्फोरिस अग्ला]
फॉस्फोरस अम्ल (H3PO3)
बनाने की विधि – PCl3 पर आक्सेलिक अम्ल की क्रिया द्वारा H3PO3 प्राप्त होता है।
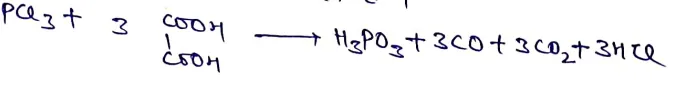
भौतिक गुण:-
- (i) यह एक क्रिस्टलीय ठोस पदार्थ है।
- (ii) यह जल में घुलनशील है।
रासायनिक गुण:-
(1) ताप का प्रभाव – फास्फोरस अम्ल को 200oC ताप पर गर्म करने पर फास्फोरिक अम्ल प्राप्त होता है।
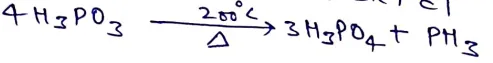
फास्फोरिक अम्ल(H3PO4)
बनाने की विधि:-
(i) P2O5 को जल के साथ गर्म करने पर।
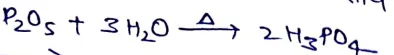
(ii) PCl5 को जल के साथ गर्म करने पर

(III) प्रयोगशाला विधि – लाल फास्फोरस कों HNO3 के साथ गर्ग करने पर |

भौतिक गुण:-
- (i) यह सफेद रंग का क्रिस्टलीय ठोस पदार्थ है।
- (ii) यह जल में अल्प विलेय है।
रासायनिक गुण
ताप का प्रभाव:- पहले पायरो फास्फोरिक अम्ल प्राप्त होता है जो उच्च ताप पर गर्म करने पर मेटा फास्फोरिक अम्ल में परिवर्तित हो जाता है।

Note:- फास्फोरस के दो प्रमुख बनियो के नाम –
- (1) फॉस्फेट रॉक (Ca3[P04]2)
- (2) फ्लोटो एपटाइट [Ca3(PO4)2 . Ca F2]
ऑक्सीजन परिवार [वर्गी16] या VIA
आवर्त सारणी के वर्गी16 में 5 तत्व O, S, Se, Te, Po रखे गये है। इन तत्वो को ऑक्सीजन परिवार कहते हैं।
आवसीजन परिवार के तत्वो को कैल्कोजन भी कहते हैं।
उपलब्धता:- O [46.6%] – सबसे अधिक मात्रा में जबकि Se व Te सल्फाइडो अयस्को मे क्रमश: धातु सेलेनाइडो और टेल्यूराइडो के रूप मे पाया जाता है।
ऑक्सीजन परिवार के सामान्य लक्षण –
(i) इलेक्ट्रानिक विन्यास:- इन तत्वो के बाह्य कोश का सामान्य इलेक्ट्रानिक विश्वास ns2 np4 होता है।
(ii) परमाणु त्रिज्या:- समूह में ऊपर से नीचे आने पर परमाणु त्रिज्या बढ़ती है।
O<S < Se <Te <Po
(iii) आयनन विभव – इन तत्वो का आयनन विभव कम होते है, जो समूह में ऊपर से नीचे की ओर घटते है।
O> S > Se> Te
(iv) विद्युत ऋणात्मकता:- इनकी विद्युत ऋणात्मकता अधिक होती है जो ऊपर से नीचे आने पर घटती हैं।
(v) आवसीकरण संख्या− आक्सीजन की सामान्य ऑक्सीकरण अवस्था -2 होती है जबकि वर्ग के अन्य सदस्य -2, +2, +4, +6 आक्सीकरण अवस्था दिखाते है।
(vi) हाइड्राइडो की प्रकृति:- इन तत्वो के हारड्राइडो के अम्लीय गुण और अपचायक गुण नीचे की ओर बढ़ते है।
ऑक्सिजन (O2)
निर्माण की विधि:- प्रयोगशाला मे आक्सीजन युक्त लवणो जैसे क्लोरेट, नाइट्रेट तथा परमैगनेट को गर्म करके ऑक्सीजन प्राप्त की जाती है।

गुणधर्म –
- (I) आण्विक ऑक्सीजन अनुचुम्बकीय होती है।
- (II) यह कुछ धातुओ (Au, Pt) तथा कुछ उत्कृष्ट गैसी को छोड़कर सभी धातुओ और अधातुओ से क्रिया करती है।
- (III) ऑक्सीजन परमाणु, छोटे परमाणु आकार, अधिक विद्युतऋणात्मकता तथा संयोजी कक्ष मे रिक्त कक्षको की अनुपस्थिति के कारण असामान्य व्यवहार प्रदर्शित करता है।
उपयोग-
- (i) श्वसन तथा दहन प्रक्रिया में।
- (ii) ऑक्सी ऐसी टिलीन वैल्डिंग में।
- (iii) धातुओं के निष्कर्ष में।
- (iv) पर्वतरोहण तथा अस्पतालों में ऑक्सीजन सिलेण्डर के रूप में।
आक्सीजन के यौगिक
(i) ऑक्साइड :-
आक्सीजन का किसी अन्य तत्व के साथ द्विअंगी यौगिक आक्साइड कहलाता है। सामान्यतः धातु के ऑक्साइड क्षारकीय और कुछ उभयधर्मी (ZnO, Al2O3) प्रकृति के होते है, जबकि अधातुओ के ऑक्साइड अम्लीय तथा कुछ उदासीन [NO, CO, N2O] प्रकृति के होते है।
(ii) O3 (ओजोन)
संरचना सूत्र – O=O → O
बनाने की विधियां –

भौतिक गुण –
- (I) यह नीले रंग के द्रव या क्रिस्टल के रूप में पाला जाता है।
- (II) यह एक विषैली गैस है।
- (III) इसकी मछली जैसी गंध होती है।
- (IV) यह गुण से लगभग 16 गुना भाटी होती है।
- (v) क्वथनांक -112.4°C
- (VI) यह प्रतिचुम्बकीय होता है |
रासायनिक गुण:-
(i) ताप का प्रभाव –
यह 250-300o C ताप पर पुन: O2 में परिवर्तित हो जाता है।

(ii) आक्सीकारक गुण – ओजोन साधारण ताप पर नवजात [0] देता है अत: यह एक प्रबल ऑक्सीकारक है|
O3 → O2+ (O)
(iii) अपचायक गुण
2O2 + O3 → 2O2 +H2O
(iv) विरंजक गुण:- यह एक अच्छा विरंजक है जो रंगीन पदार्थो का आक्सीकरण कर उन्हें रंगहीन कर देता है।
उपयोग:-
- (i) जल के शोधन में
- (ii) विरंजक के रूप में।
- (iii) आक्सीकारण के रूप मे
- (iv) कीटाणुनाशक के रूप मे
- (v) कृत्रिशू रेशम एवं कपूर बनाने में
सल्फर
सल्फर मुक्त एवं संयुक्त दोनो अवस्थाओ में पाया जाता है। भू-पर्पटी मे सल्फर की उपलब्धता केवल 0.03 से 1% है।
सल्फर के यौगिक
(i) सल्फर डाई आक्साइड (SO2)
- अणुसूत्र = SO2
- अणुभार= 32+ 2×16= 64
बनाने की विधियां:-
(i) सल्फर (गंधक) को ऑक्सीजन के साथ गर्म करने पर –

(ii) प्रयोगशाला विधि- प्रयोगशाला में ताबे की छीलन पर गर्ग सान्द्र सल्फ्यूरिक अम्ल की क्रिया द्वारा सल्फरडाई आक्साइड (S02) बनती है

भौतिक गुण:-
- (I) यह एक रंगहीन, तीक्ष्ण गंध युक्त दम घुटने वाली गैस है।
- (II) यह ठण्डे जल में घुलनशील एवं गर्म जल में अघुलनशील है।
- (III) यह अम्लीय KMnO4 विलयन को रंगहीन कर देता है।
रासायनिक गुण –
(i) 02 से क्रिया:- यह 450°C पर pt उत्प्रेरक की उपस्थिति में O2 से क्रिया करके S03 में परिवर्तित हो जाती है।
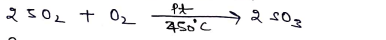
(II) ऑक्सीकारक गुण
(a) यह H2S को S में आक्सीकृत कर देता है।

(b) यह Fe को फेरस ऑक्साइड में ऑक्सीकृत कर देती है।

(iii) अपचायक गुण-
- (a) यह अम्लीय K2Cr207 को क्रोमिक सल्फेट में अपचारित देता है।
- (b) यह KMnO4 को रंगहीन मैग्नस सल्फेट में अपचवित कर देता है।
उपयोग –
- (1) H2S04 के निर्माण में।
- (2) चीनी को शुद्ध करने में
- (3) रेशम, ऊन, बाल इत्यादि के विरंजन में।
- (4) कीटाणुनाशक के रूप में ।
सल्फ्यूरिक अम्ल (H2SO4)
बनाने की विधियां:-
(I) S02 की HNO3 की क्रिया द्वारा –

(II) H2 S04 के निर्माण की औद्योगिक विधियाँ
- (a) लेड चेम्बर विधि (सीस कक्ष विधि)
- (b) सम्पर्क कक्ष विधि
भौतिक गुण:-
- (I) यह रंगहीन तैलीय द्रव है।
- (II) यह जल में विलय है।
- (III) यह त्वचा पर गिरने पर घाव उत्पन्न करता है।
रासायनिक गुण:-
(i) ताप का प्रभाव – इसे गर्म करने पर SO3 व जल प्राप्त होता है।

(ii) अधातुओं से क्रिया (ऑक्सीकरण)
- (a) यह C को CO2 में आक्सीहत कर देता है।
- (b) यह P को आर्थ्रो फास्फोरिक अम्ल में परिवर्तित कर देता है।
- (C) यह आयोडीन को आयोडिक अम्ल में आनसीहत कर देता है।
- (d) यह KI को आयोडीन में ऑक्सीकृत कर देती है।
(iii) धातुओ से क्रिया
(a) सक्रिय धातुओ से क्रिया:-
- 2Na +H2SO4 → Na2SO4 + H2
- Zn + H2SO4 → ZnSO4 + H2
- 2Al + 3H2SO4 → Al(SO4)3 + 3H2
(b) कम सक्रिय धातुओ से क्रिया –
(a) Cu से क्रिया- यह गर्म तथा सान्द्र H2S04 से क्रिया कर CuSO4 बनता है।

(b) Ag से क्रिया – यह गर्म व सान्द्र H2S04 से क्रिया कर Ag2SO4 बनाता है ।

(iv) निर्जलीकरण:- C2H3OH को Conn. H2S04 के साथ 160°C पर गर्म करने पर इसके निर्जलीकरण से एथिलीन गैस प्राप्त होती है।

उपयोग:-
- (I) निर्जलीकारक के रूप में।
- (II) पेट्रोलियम के शोधन में।
- (III) आक्सीकारक के रूप में।
- (Iv) सीसा संचायक सेलो में ।
हैलोजन परिवार (वर्ग 17 या VII A)
आवर्त सारणी के VIIB समूह में 5 तत्व F, Cl, Br, I, At रखे गये है, इन तत्वो को हैलोजन परिवार कहते है क्योंकि ये तत्व समुद्री जल में पाये जाते है तथा AT रेडियो एक्टिव तत्व है।
हैलोजन परिवार के सामान्य लक्षण :-
- (i) e– विन्यास – इनके बाह्य कोश का विन्यास ns2, np5 होता है।
- (ii) भौतिक अवस्था- F2 से I2 तक आकार मे वृद्धि के साथ वाण्डरवाल्स बलो में वृद्धि होने के कारण गैसो से ठोस मे परिवर्तित हो जाती है। अत फ्लोरीन तथा क्लोरीन गैस अवस्था में, ब्रोमीन द्रव तथा आयोडीन ठोस अवस्था में पायी जाती है।
- (iii) परमाणु त्रिज्या:- समूह में ऊपर से नीचे ऊपर से नीचे जाने पर परमाणु क्रिया बढ़ती है।
- F <Cl < Br<I
- (iv) विद्युत ऋणात्मकता:- इनकी विद्युत ऋणात्मकता सबसे अधिक होती है जो समूह में ऊपर से नीचे की ओर घटती है।
- F>Cl> Br>I
- (v) इलेक्ट्रान बंधुता:- इनकी e– बंधुता सबसे अधिक होती है जो समूह में ऊपर से नीचे की ओर घटती है।
- Cl >F>Br>I
- (vi) ऑक्सीकरण अवस्था:- सभी तत्व -1 आक्सीकरण अवस्था प्रदर्शित करते है।
- (vii) रंग – समूह में नीचे की ओर जाने पर तत्वो का रंग गहरा होता जाता है।
क्लोरीन (Cl2)
बनाने की विधिया
(1) प्रवल आक्सीकारको जैसे- MnO2, KMnO4 K2Cr2 07 की क्रिया HCl से कराने पर Cl2 का निर्माण होता है।

(2) ब्लीचिंग पाउडर पर Dil. H2S04 की क्रिया द्वारा –
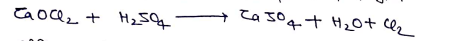
(3) औद्योगिक विधि (डीकन विधि)
HCl गैस व वायु के मिश्रण को CuCl2 उत्प्रेरक की उपस्थिति में गर्म करने पर Cl2 गैस प्राप्त होती है।

भौतिक गुण –
- (i) यह पीला रंग वाली तीक्ष्ण गंध की गैस है।
- (ii) यह जल में विलेय है।
- (iii) यह वायु तथा आक्सीजन से भारी है ।
रासायनिक गुण:-
(i) NaOH से क्रिया:- गर्म व सान्द्र NaOH से क्रिया द्वारा सोडियम क्लोरेट प्राप्त होता है।

(II)शुष्क व बुझे चूने से क्रिया:- ब्लीचिंग पाउडर प्राप्त होता है।

(III) अमोनिया से क्रिया-
(a) NH3 की अधिकता में अमोनियम क्लोराइड प्राप्त होता है
(b) Cl2 की अधिकता में विस्फोटक NCl3 बनता है।

(iv) आक्सीकारक गुण
(a) यह KI को I2 में आक्सीकृत कर देता है।

(b) यह S02 को H2S04 में ऑक्सीकृत कर देता है।

(vi) विरंजक गुण – Cl2 अपने आक्सीकारक गुण के कारण रंगीन पदार्थो का रंग उड़ा देता है।
उपयोग –
- (I) विरंजक के रूप में
- (II) कीटनाशक के रूप में
- (III) क्लोरोफार्म तथा फास्जीन के निर्माण में।
- (IV) ब्लीचिंग पाउडर के निर्माण में।
क्लोरीन का परीक्षण:-
- (i)Cl2 का हरा पीला रंग होता है व इसकी गंध तीक्ष्ण होती है।
- (ii) स्टार्च आयोडाइड से भीगे कागज को क्लोरीन नीला कर देती है।
- (iii) इसका जलीय विलयन नीले लिटमस को लाल रंग देता है।
- (iv) यह फूल-पत्तियों का रंग उड़ा देती है ।
हाइड्रोजन क्लोराइड (HCl)
बनाने की विधियों –
(1) सूर्य के प्रकाश की उपस्थिति मे H2 व Cl2 की क्रिया द्वारा |

(2) प्रयोगशाला विधि – प्रयोगशाला में HCl गैस का निर्माण सोडियम क्लोराइड तथा सान्द्र H2S04 को एक साथ गर्म करके किया जाता है।
(3) H2S से Cl2 की क्रिया द्वारा:-

भौतिक गुण –
- (1) यह एक इंगहीन तीक्ष्ण गन्ध युक्त गैस है।
- (2) यह जल में विलेध है।
रासायनिक गुण:-
(1) अमोनिया से क्रिया – NH4Cl प्राप्त होता है।
NH3 + HCl → NH4Cl
(II) धातुओं से क्रिया – धातु क्लोराइड प्राप्त होता है।

(III) धातु आक्साइड से क्रिया – धातु क्लोराइड तथा जल प्राप्त होता हैं।

(IV) धातु कार्बोनेट से क्रिया – लवण प्राप्त होता है।
उपयोग:-
- (i) Cl2 बनाने में।
- (ii) अम्लराज बनाने में।
- (iii) चमड़े के शोधन में ।
HCl के परीक्षण:-
- (I) HCl गैस या अम्ल NH3 गैस के साथ अमोनियम क्लोराइड का सफेद धूम्र बनाता है।
- (II) HCl का जलीय विलयन सिल्वर नाइट्रेट के विलयन के साथ AgCl का सफेद अवक्षेप बनाता है जो नाइट्रिक अम्ल मे अविलेय है।
विरंजक चूर्ण या ब्लीचिंग पाउडर
रासायनिक नाम:- कैल्सियम क्लोरो हाइपोक्लोराइट
अनुसूत्र:- CaOCl2 अणुभार = 127
बनाने की विधि-
विरंक्षक चूर्ण का निर्माण शुष्क बुझे चुने पर क्लोरीन की क्रिया द्वारा किया जाता है।
Ca(OH)2 + Cl2 → CaOCl2 + H2O
भौतिक गुण:-
- (1) यह हले पीले रंग का पाउडर होता है।
- (2) इसमें Cl2 की तीक्ष्ण गंध आती है।
- (3) यह ठण्डे जल में विलेय है।
रासायनिक गुण-
(1) CO2 से क्रिया – CaCO3 प्राप्त होती है तथा Cl2 गैस मुक्त होती है।

(2) Dil. H2 S04 से क्रिया. – Cl2 गैस प्राप्त होती है।

(3)ऑक्सीकारक गुण
(a) यह H2S को सल्फर में ऑक्सीकृत कर देता है।

(b) यह अम्लीय माध्यम में KI को आयोडीन में ऑक्सीकृत कर देती है।
(4) विरंजक गुण:- ब्लीचिंग पाउडर तलु अग्लो से क्रिया कर नवजात ऑक्सीजन देता है जो रंगीन पदार्थो का रंग उड़ा देती है।
उपयोग:-
- (1) क्लोरोफार्म बनाने में |
- (2) कीटाणुनाशक के रूप में।
- (3) विरंजक के रूप में ‘
- (4) पेयजल को शुद्ध करने में।
- (5) अभिक्रमक के रूप में।
अन्तर हैलोजन यौगिक
- जब दो भिन्न-भिन्न हैलोजन परस्पर क्रिया करके सहसंयोजी यौगिक बनाते है तो इन यौगिको को अन्तर हैलोजन यौगिक कहते है।
- इनका सामान्य सूत्र ABn होता है। जहाँ n=1, 3, 5,7— , तथा A व B हैलोजन है जिसमे A बड़े आकार का हैलोजन है
- Ex: ClF, BrF, ClF3, ICl3, BF5, IF7
अन्तर हैलोजन के प्रकार:- ये 4 प्रकार के होते है
- (1) AB – ClF, BF
- (2) AB3 – ClF3, ICl3
- (3) AB5 – BrF5
- (4) AB7 – IF7
अन्तर हैलोजन यौगिक बनाने की विधियां
(1) AB प्रकार के यौगिक बनाने की विधि –

(2) AB3 प्रकार के यौगिक बनाने की विधि

(C) AB5 प्रकार के यौगिक बनाने की विधि –

अंतर हैलोजन यौगिक के लक्षण
- (1) इनकी प्रकृति प्रतिचुम्बकीय होती है।
- (2) यह सहसंयोजी प्रकृति के होते हैं।
- (3) ये प्रबल आक्सीकारक होते हैं।
- (4) इनकी क्रियाशीलता हैलोजन से अधिक होती है।
- (5) इनके गलनांक व क्वथनांक उच्च होते हैं।
अक्रिय गैसे/ उत्कृष्ठ गैसे (समूह 18) शून्य वर्ग
- आवर्त सारणी के शून्य समूह में 6 तत्व He, Ne, Ar, Kr xe, Rn शरखे गये हैं । इन तत्वों को अक्रिय गैस कहते है क्योंकि इनके बाह्यतम कोश पूर्व पुरित होते है जिसके कारण ये अभिक्रिया नहीं करती है।
- He को छोड़कर सभी तत्वो के बाहयतम कोश में 8e – होते हैं इसीलिए इनकी संयोजकरण 0 होती है अत: इन्हें 0 समूह में रखना उचित है।
अक्रिय गैसो के लक्षण:-
- (1) ये गैसे रंगहीन, गंधहीन, स्वादहीन तथा एक परमानिवक होती है ।
- (2) उत्कृष्ट गैसो की त्रिज्याएं वाण्डर वाल त्रिज्याएं होती है।
- (3) इनका आयनन विभव उच्च होता है। क्योंकि इनका e– विचास स्थायी व पूर्ण होता है। अत: e– के निष्कासन में अधिक ऊर्जा की आवश्यकता होती है।
- (4) इनकी e– लब्धि एन्थैल्पी का मान अधिक धनात्मक होता है।
- (5) ये जल में अल्प विलेय होती है।
अक्रिय गैसो की खोज:- अक्रिय गैसो की खोज रैले, रैमने व डार्न ने की थी ।
He, Ne, As, Kr, Xe की खोज रैले व रैमजे ने की थी जबकि Rn की खोज डार्न ने की थी।
उत्कृष्ट गैसो की प्राप्ति:-
- (1) अक्रिय गैसो के मुख्य स्त्रोत रेडियोऐक्टिव खनिज, प्राकृतिक गैस तथा वायुमण्डल इत्यादि है।
- (2) हीलियम का मुख्य स्त्रोत मोनोजाइट सेण्ड है जोकि एक रेडियोएक्टिव खनिज है। He तथा Rn को रेडियम के रेडियोएक्टिव विघटन द्वारा भी प्राप्त किया जाता है।
- (3) क्लीवाट खनिज में भी हीलियम उपस्थित होती है। वायु में निष्क्रिय गैसो का पृथक्करण फिशर-रिंग विधि द्वारा किया जाता है।
- (4) हीलियम तथा निऑन के मिश्रण को 93k चारकोल के सम्पर्क में लाने पर निऑन पूर्ण रूप से अधिशोषित हो जाती है। हीलियम मुक्त हो जाती है, परन्तु अधिशोषित नहीं होती है।
उत्कृष्ट गैसो के उपयोग:-
- (1) खत में कम विलेयता के कारण हीलियम तथा ऑक्सीजन के मिश्रण का उपयोग गोताखोरो द्वारा सांस लेने में किया जाता है।
- (2) हल्की तथा अज्वलनशील होने के कारण हीलियम गुब्बारों तथा वायुयानों के टावरों आदि को भरने में प्रयुक्त होती हैं।
- (3) हीलियम का उपयोग शीतित नाभिकीय रिएक्टरों में किया जाता है।
- (4) निऑन का उपयोग कोहरे को भेदने वाले लैम्प बनाने में किया जाता है।
- (5) निऑन ट्यूब विज्ञापन चिन्हों के रूप में और सजावट करने में प्रयुक्त होती है।
जीनान (Xe) के यौगिक
(a) जीनॉन – फ्लुओरीन यौगिक
- (i) जीनॉन डाइफ्लुओराइड [XeF2] → संरचना = रैखिक
- (ii) जीनॉन ट्रेटा फ्लुओराइड[XeF4] → संरचना = वर्ग समतलीय
- (iii) जीनॉन हेक्सा फ्लुओराइड [xeF6] → संरचना = विकृत अष्टफलकीय
(b) जीनॉन आक्सीजन के यौगिक
- (i) जीनॉन ऑक्सी ट्रेटाफ्लुओराइड [XeOF4] → संरचना = वर्ग पिरामिडीय
- (ii) जीनान ट्राई आवसाइड [Xe03] → संरचना = त्रिकोणीय पिरामिडीय
Tagged with: P block Elements notes in hindi
