यहाँ हमने Class 11 Chemistry Chapter 9 Notes in Hindi दिये है। Class 11 Chemistry Chapter 9 Notes in Hindi आपको अध्याय को बेहतर ढंग से समझने में मदद करेंगे और आपकी परीक्षा की तैयारी में सहायक होंगे।
Class 11 Chemistry Chapter 9 Notes in Hindi हाइड्रोजन
हाइड्रोजन के समस्थानिक
हाइड्रोजन के 3 समस्थानिक होते हैं।
- प्रोटियम (1H1)
- ड्यूटीरियम(1H2) या भारी हाइड्रोजन (D2)
- ट्राइटियम (1H3)
प्रोटियम (1H1) के नाभिक में न्यूट्रॉन नहीं पाये जाते हैं।
ड्यूटीरियम
बनाने की विधियां
1. भारी जल द्वारा
जब भारी जल की क्रिया सोडियम धातु से कराते हैं तो ड्यूटीरियम प्राप्त होता है।
2D2O + 2Na → 2NaOD +D2
इसी प्रकार Mg, Zn तथा Fe भी ड्यूटीरियम का निर्माण करते है।
2. प्रयोगशाला विधि
जब रक्त तप्त टंगस्टन तन्तु की क्रिया भारी जल से कराते हैं तो D2 प्राप्त होती है।
2D2O + W → WO2 + 2D2
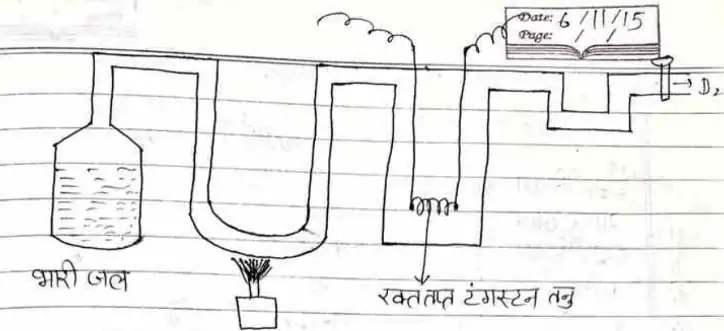
एकपात्र में भारी जल भरकर वाष्पित करने पर उसे टंगस्टन तन्तु लगे कक्ष में प्रवाहित करने पर उच्च ताप पर अपचयन से भारी हाइड्रोजन (D2) मुक्त होती है , जिसे पंप द्वारा बाहर निकाल लेते हैं।
भौतिक गुण
ये रंगहीन, गन्धहीन, स्वादहीन जल में अविलय गैस है।
रासायनिक गुण
- नाइट्रोजन से क्रिया-ड्यूटेरो अमेनिया प्राप्त होती है
- N2 + 3D2 → 2ND3
- ऑक्सीजन से क्रिया भारी जल बनता है।
- 2D2 + O2 → 2D2O
- नोट: D2 ज्वलनशील गैस है परंतु यह जलाने में सहायक नहीं है। यह ऑक्सीजन के साथ विस्फोट से जलती है। जिससे भारी जल बनता है।
- क्लोरीन से क्रिया= डयूटीरियम क्लोराइड बनता है।
- अमोनिया से क्रिया = ड्यूटेरो अमोनिया बनती है।
- ऐथेन से क्रिया = ड्यूटेरो ऐथेन बनता है।
- H2SO4 से क्रिया = H2 गैस मुक्त होती है।
डयूटीरियम के उपयोग
- भारी जल के निर्माण में
- डयूटीरियम के यौगिक बनाने में
- तत्वों के कृत्रिम विघटन में।
- न्यूक्लियर रिक्टर में मन्दक के रूप में।
भारी जल (D2O)
- संरचना सूत्र = D-O-D
- अणुभार = 2O
- खोजकर्ता = यूरे
- इलेक्ट्रॉन की संख्या = 10
- डयूटीरियम के ऑक्साइड को भारी जल कहते हैं।
बनाने की विधियां
(i) ड्यूटीरियम से ड्यूटीरियम को ऑक्सीजन के साथ जलाने पर भारी जल प्राप्त होता है।
(ii). साधारण जल तथा ड्यूटीरियम के विनिमय द्वारा
(iii) साधारण जल के विद्युत अपघटन द्वारा
साधारण जल के 6000 भाग में 1 भाग भारी जल होता है। इस क्षार युक्त जल का विद्युत अपघटन करने पर भारी जल प्राप्त होता है।
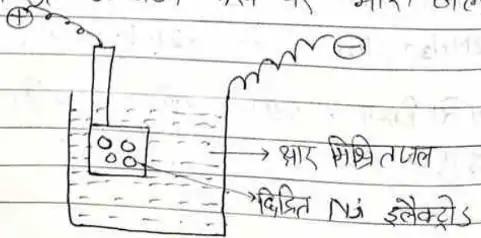

इसमें एक पात्र में साधारण जल (क्षार मिश्रित) लेते हैं जिसमें छिद्रित Ni इलैक्ट्रोड धनोड़ का कार्य करता है तथा पात्र की दीवार कैथोड का कार्य करती है। विद्युत धारा प्रवाहित करने पर साधारण जल H2 तथा O2 के रूप में बाहर निकल जाते है।
प्रथम चरण में 1/6 आयतन तक विद्युत अपघटन करते हैं जिससे भारी जल का सान्दर्ण 2.5% होता है। दूसरे चरण में सान्द्रण 12% होता है ,इस प्रकार 7वें चरण मे100% सान्द्रता का भारी तक विद्युत प्राप्त होता है।
भौतिक गुण
यह रंगहीन गन्धहीन, स्वादहीन द्रव है।
रासायनिक गुण
- धातुओं से क्रिया – D2 मुक्त होती है।
- 2Na+2D2O → 2NaOD+D2
- Zn+2D2O → Zn(OD)2+D2
- अधातुओं से क्रिया
- P2O5+3D2O → 2D3PO4 (ड्यूट्राफास्फोरिक एसिड)
- SO3+O2O → D2SO4 (ड्यूटा सल्फ्यूरिक एसिड)
- कार्बाईड ,नाइट्रइड, फास्फाइड से क्रिया
- CaC2+2D2O → Ca(OD)2+C2D2 ड्यूट्रा एसिटलीन
- AlN + 3D2O → Al(OD)3 + ND3 ड्यूट्रा अमोनिया
- CaP2 + 6D2O → 3Ca(OD)2 + 2PD3 ड्यूट्रा फास्फीन
- विनमय अभिक्रियाये
- NH3 से क्रिया- 2NH3 +3D2O → 2ND3+,3H2O
- H2SO4 से क्रिया H2SO4 + D2O → D2SO4 + H2O
- CH4 से क्रिया CH4 + 2D2O → CD4 + 2H2O
उपयोग
- नाभिकीय रिक्टर मे मन्दक के रूप में
- डयूटीरियम बनाने में
- ट्रेशर के रूप में
हाइड्रोजन पर ऑक्साइड (H2O2)
H2O2 की खोज सन् 1818 में थीनार्ड ने की थी। यह वायुमंडल में अल्प मात्रा में तथा पौधो मे पाया जाता है। यह दो रूपो मे पाया जाता है।


बनाने की विधियां
- सोडियम पर ऑक्साइड पर तनु ठण्डे H2SO4 की क्रिया द्वारा
- NaO2+H2SO4 – Na2+Na2SO4
- बोरियम पर ऑक्साइड पर कार्बन डाइऑक्साइड की क्रिया द्वारा
- BaO2 + CO2 + H2O → H2O2 + BaCO3
- प्रयोगशाला विधि
- जल योजित बेरियम परऑक्साइड की क्रिया तनु H2SO4 से कराने पर H2O2 प्राप्त होता है।
औद्योगिक विधि
(i) H2SO4 की विद्युत अपघट्य द्वारा:- 50% H2SO4 का विद्युत अपघटन कराने पर कैथोड पर H2 तथा एनोड पर डाइसल्फ्यूरिक अम्ल(H2S2O8) प्राप्त होता है। जिसके जल अपघट्य पर H2O2 प्राप्त होता है।
(ii) अमोनियम हाइड्रोजन सल्फेट द्वारा:- अमोनियम हाइड्रोजन सल्फेट के विद्युत अपघट्न पर एनोड पर अमोनियम पर डाइ सल्फेट बनता है जिसका H2SO4 की उपस्थिति में जल अपघटन करने पर H2O2 प्राप्त होता है।
H2O2 का सान्द्रण
H2O2 की सान्द्रता 30% होती है, इसे निम्न विधियों द्वारा सान्द्रित किया जाता है।
(i) ठण्डा करके:- जब H2O2 को बर्फ के मिश्रण में रखकर ठण्डा करते हैं तो जल बर्फ बनकर अलग हो जाता है। और शेष बचे विलयन में H2O2 की प्रतिशत मात्रा बढ़ जाती है।
(ii) आसवन द्वारा (कम दाब पर आसवन द्वारा):- जब H2O2 को 13mm दाब व 60°C ताप पर आसवन करते है तो जल की अधिकांश मात्रा वाष्पित हो जाती है, और H2O2 का विलयन शेष रह जाता है। इसका कई पदों में प्रभाजी आसवन करने पर 99% H2O2 प्राप्त होती है ।
(iii) वाष्पन द्वारा:- H2O2 को जल उष्मक पर 60-70°c पर वाष्पित करने पर जल वाष्पित हो जाता है तथा 45% सांद्रता का H2O2 विलियन प्राप्त होता है।
Chapter 3: तत्वों का वर्गीकरण एवं आवर्तिता
Chapter 2: परमाणु संरचना
Chapter 6: ऊष्मागतिकी
भौतिक गुण
- इसका क्वथनांक 51°c होता है।
- यह त्वचा पर गिरने पर फफोले उत्पन्न करता है।
रासायनिक गुण
- (i) विघटन:- यह उच्च ताप पर विघटित होकर जल व नवजात O देता है। H2O2 → H2O+(O)
- (ii) अम्लीय प्रकृति:- यह सोडियम कार्बोनेट मिलाने पर सोडियम परऑक्साइड तथा CO2 गैस उत्पन्न करती है जिससे H2O2 के अम्लीय प्रकृति की पुष्टि होती है।
- H2O2+Na2CO3 → Na2O2+H2O+CO2
- (iii) ऑक्सीकारक गुण:- H2O2 अम्लीय व क्षारीय दोनों माध्यमों में प्रबल ऑक्सीकारक है। इसकी प्रमुख अभिक्रियायें निम्न हैं।
- (a) H2S का सल्फर में ऑक्सीकरण:- H2S + H2O2 → 2H2O+S
- (b) KI को आयोडीन में ऑक्सीकरण:- 2KI + H2O2 → 2KOH +I2
- (c) फेरस सल्फेट का फेरिक सल्फेट में ऑक्सीकरण:- 2FiSO4 + H2O2 + H2SO4 → Fi(SO4)3 + 2H2O
- (d) लेड सल्फाइड का लेड सल्फेट मे ऑक्सीकरण:- PBS+ 4H2O2 → PbSO4 + 4H2O
- (e) पोटेशियम फैरो साइनाइड का पोटेशियम फैरी सायनाइड में ऑक्सीकरण:- 2Ku[Fi(CN)6]+H2O2+H2SO4 → 2k3[Fi(CN)6]+ K2SO4+2H2O
- (f) बेरियम सल्फाइड का बेरियम सल्फेट मे ऑक्सीकरण:- BaS + 4H2O2 → BaSO4 + 4H2O
- (iv) अपचायक गुण:- H2O2 प्रबल ऑक्सीकारकों को अपचयित कर देता है, इसकी प्रमुख अभिक्रियाएं निम्न हैं।
- लेड डाई ऑक्साइड का लेड ऑक्साइड में अपचयन:- PbO2 + H2O2 → PbO+ H2O + O2
- ओजोन का ऑक्सीजन में अपचयन:- O3+ H2O2 → 2O2+H2O
- सिल्वर ऑक्साइड का चांदी में अपचयन:- Ag2O+H2O2 → 2Ag + H2O + O2
उपयोग
- H2O2 का उपयोग घावों को धोने में दांत, कान साफ करने में।
- पुराने तेल चित्रों की सफाई करने में
- रेशम, उन, बाल, हाथी दांत इत्यादि के विरंजन में
- रॉकेट, पनडुब्बी, जेट इत्यादि के ईंधन के रुप में
Tagged with: chemistry chapter 9 class 11 notes in hindi | chemistry class 11 chapter 9 in hindi notes | class 11 chemistry chapter 9 ncert notes in hindi | Class 11 chemistry Chapter 9 Notes in Hindi | Hydrogen Notes in Hindi