यहाँ हमने Class 11 Chemistry Chapter 6 Notes in Hindi दिये है। Class 11 Chemistry Chapter 6 Notes in Hindi आपको अध्याय को बेहतर ढंग से समझने में मदद करेंगे और आपकी परीक्षा की तैयारी में सहायक होंगे।
Class 11 Chemistry Chapter 6 Notes in Hindi ऊष्मागतिकी
ऊष्मागतिकी:- भौतिक रसायन की वह शाखा जिसमें किसी भौतिक एवं रासायनिक परिवर्तन के फलस्वरूप ऊर्जा की मात्रा का अध्ययन किया जाता है ऊष्मागतिकी कहलाती हैं।
निकाय अथवा तन्त्र (System):- ब्रह्माण्ड का वह विशेष निश्चित, वास्तविक या काल्पनिक भाग जिसे ऊष्मागतिकी अध्ययन के लिए चुना जाता है System कहलाता है।
परिवेश(surrounding):- निकाय को छोड़कर उसके चारों ओर का वह क्षेत्र जो निकाय को ऊर्जा तथा द्रव्यमान दोनो का आदान प्रदान कर सकता है परिवेश कहलाता है।
निकाय के प्रकार
निकाय 3 प्रकार के होते हैं
(i) खुला निकाय(open system)
वह निकाय जो अपने परिवेश से ऊर्जा तथा द्रवामान दोनों का आदान प्रदान कर सकता है, खुला निकाय कहलाता है। Ex. खुले बीकर में रखा गर्म पानी ।
(ii) बन्द अथवा संवृत निकाय (close system)
वह निकाय जो अपने परिवेश से उर्जा का आदान प्रदान कर सकता है परन्तु द्रव्यमान का नहीं, बन्द निकाय कहलाता है। Ex. एक बन्द पात्र में भरा गर्म जल।
(iii) विलगित निकाय (Isolated system)
वह निकाय जो अपने परिवेश से ऊर्जा तथा द्रव्यमान दोनों मे से किसी का आदान प्रदान नहीं करता है, विलगित निकाय कहलाता है। जैसे थरमस में भरा गर्म जल।
विस्तीर्ण तथा अविस्तीर्ण गुण
वे गुण जो निकाय में उपस्थित पदार्थ की मात्रा पर निर्भर करते हैं विस्तीर्ण गुण कहलाते हैं।
Ex- आयतन, द्रव्यमान, ऊष्मा धारिता, एन्थेल्पी, एन्ट्रापी
वे गुण जो निकाय में उपस्थित पदार्थ की मात्रा पर निर्भर नहीं करते हैं। अविस्तीर्ण गुण कहलाते हैं।
जैसे:- ताप, दाब, घनत्व, द्विध्रुव आघूर्ण, क्वथनांक, हिमांक आदि
ऊष्मा गतिक प्रकृम
जब कोई ऊष्मा गतिक तन्त्र एक अवस्था से दूसरी अवस्था में परिवर्तित हो जाता है तो उस परिवर्तन को उष्मागतिक प्रक्रम कहते हैं।
यह निम्न प्रकार का होता है
- (i) समतापीय प्रकृम:- समतापीय प्रक्रम में निकाय का ताप स्थिर रहता है अर्थात dt=0
- (ii) रुहोष्म प्रक्रम:- रुहोष्क प्रक्रम में ऊष्मा का आदान प्रदान नहीं होता है अर्थात dq=0
- (iii) समदाबीय प्रक्रम:- समदाबीय प्रक्रम में में निकाय का दाब स्थिर रहता है अर्थात dp=0
- (iv) समआयतनिक प्रक्रम:- इसमें आयतन नहीं बदलता है अर्थात dv=0
अवस्था फलन
निकाय का वह गुण जिसका मान केवल निकाय की वर्तमान अवस्था पर निर्भर करता है ना कि उस विधि पर जिसके द्वारा वह अवस्था प्राप्त हुई है। अवस्था फलन कहलाती है।
जैसै:- आन्तरिक ऊर्जा, एन्थेल्पी, एन्ट्रॉपी, ताप इत्यादि अवस्था फलन है।
ऊष्मा गतिकी का प्रथम नियम
ऊष्मागतिकी के प्रथम नियम को कई प्रकार से परिभाषित किया गया है। इसे ऊर्जा संरक्षण का नियम भी कहते हैं। जिसके अनुसार – “ऊर्जा न तो उत्पन्न की जा सकती है और न ही नष्ट की जाती है। यद्यपि इसे एक रूप से दूसरे रुप मे परिवर्तित किया जा सकता है।”
Or
“किसी विलगित निकाय की सम्पूर्ण ऊर्जा स्थित रहती है यद्यपि यह एक रूप से दुसरे रूप में परिवर्तित की जाती है।”
यदि किसी निकाय को q ऊष्मा दी जाती है तो यह ऊष्गा निकाय की आन्तरिक ऊर्जा E1 से E2 तथा परिवेश पर W कार्य करने के बराबर होती हैं।
q =(E2 – E1) + W
q = △E + W
△E = q – W
यह ऊष्मा गतिकी के प्रथम नियम का गनितीय सूत्र है।
where △E = आंतरिक ऊर्जा मे परिवर्तन
q = निकाय द्वारा उत्सर्जित या अवशोषित ऊष्मा
नोट:
- (i) यदि कार्य निकाय पर किया जाता है तो W = -V
- (ii) कार्य निकाय द्वारा किया जाता है तो W = +ve होगा
एन्थैल्पी (अंश ऊष्मा या पूर्ण ऊष्मा)
“स्थिर दाब पर किसी निकाय की एन्थैल्पी उसकी आन्तरिक ऊर्जा E तथा PV के योग के बराबर होती है।” इसे H से प्रदर्शित करते हैं।
H = E + PV
एन्ट्रॉपी
एन्ट्रॉपी किसी निकाय की अव्यवस्था या अनियमितता की माप है”। यह एक ऊष्मागतिक गुण है, जो निकाय की अवस्था पर निर्भर करता है। इसे S से प्रदर्शित करते हैं।
यदि किसी निकाय की प्रारम्भिक तथा अन्तिम यदि अवस्थाओं की एन्ट्रॉपी S1, व S2 तथा एन्ट्रॉपी परिवर्तन ∆S हो तो
∆S =S2 – S1
Note: जो निकाय जितना अव्यवस्थित होता है उसकी एन्ट्रॉपी भी उतनी ही अधिक होती है। अंत: ठोसों की एन्ट्रॉपी सबसे कम, द्रव की उससे अधिक जबकि गैस की सबसे अधिक होती है
ऊष्मा ऊष्मागतिकी का द्वितीय नियम
इस नियम को कई प्रकार से परिभाषित किया गया है:-
- प्रकृति में सभी स्वत: परिवर्तन अनुत्क्रमणीय होते हैं।
- बिना बाह्य कार्य किये ठण्डी वस्तु से गर्म वस्तु की ओर ऊष्मा का प्रवाह स्वयं नहीं हो सकता है।
- प्रत्येक स्वत: प्रवर्तित प्रक्रम में ब्रह्माण्ड की एन्ट्रॉपी बढ़ती है।
ऊष्मागतिकी का तृतीय नियम
इस नियमानुसार परम शून्य ताप पर किसी पूर्ण क्रिस्टलीय पदार्थ की एन्ट्रॉपी शून्य होती है।
Chapter 3: तत्वों का वर्गीकरण एवं आवर्तिता
Chapter 2: परमाणु संरचना
निम्न पर संक्षिप्त टिप्पणी लिखिए।
(i) अभिक्रिया की उष्मा
ऊष्मा की वह मात्रा जो किसी रासायनिक समी. द्वारा प्रदर्शित पदार्थों की ग्राम अणु मात्राओं की पूर्ण अभिक्रिया होने पर अवशोषित या उत्सर्जित होती है, अभिक्रिया की उष्मा कहलाती है।
(ii) मानक अभिक्रिया उष्मा
मानक ताप (25°c) तथा मानक दाब (1 वायुमंडलीय) की परिस्थिति मे अभिक्रिया की जो उष्मा प्राप्त होती है, मानक अभिक्रिया उष्मा कहलाती हैं।
(iii). दहन उष्मा
किसी यौगिक या तत्व के 1 ग्राम अणु को पूर्ण दहन करने पर जो उष्मा उत्पन्न होती है उसे दहन उष्मा कहते हैं।
(iv). उत्पादन अथवा संभवन उष्मा
किसी यौगिक के अपने ही तत्वों से 1 ग्राम अणु बनाने में जितने कैलोरी ऊष्मा अवशोषित या उत्सर्जित होती है। उस यौगिक की संभवन उष्मा कहलाती है।
(v). उदासीनीकरण ऊष्मा
किसी अम्ल के 1 ग्राम तुल्यांकी भार को किसी क्षार के 1 ग्राम तुल्यांकी भार द्वारा तनु विलयन में उदासीन करने पर जो उष्मा उत्पन्न होती है, उदासीनीकरण ऊष्मा कहलाती है।
(vi). विलयन की उष्मा
जब किसी पदार्थ के 1 ग्राम अणु मोल को इतने अधिक विलायक में घोला जाए कि और अधिक विलायक मिलाने पर उत्पन्न या अवशोषित उष्मा की मात्रा अपरिवर्तित रहे तो उष्मा की यह मात्रा विलयन की उष्मा कहलाती है।
ऊष्मा रसायन के नियम
ऊष्मा रसायन के दो नियम हैं
- लेवाॉसिए तथा लाप्लास का नियम
- हेंस का नियम
1. लेवाॉसिये तथा लाप्लास का नियम
किसी यौगिक को उसके तत्वों में विघटित करने के लिए आवश्यक ऊष्मा अथवा उस यौगिक को उसके तत्वों से बनाने पर उत्सर्जित ऊष्मा बराबर होती है।
2.हेस का नियम
हेस के नियमानुसार कोई रासायनिक प्रक्रिया सीधे एक पद में कराई जाये या अनेक मध्यवर्ती पदों में परंतु अभिक्रिया द्वारा अवशोषित या उत्सर्जित उष्मा की कुल मात्रा समान रहती है।
ऊष्मा धारिता
किसी निकाय का ताप 1°C बढ़ाने के लिए आवश्यक ऊष्मा को निकाय की उष्मा धारिता कहते हैं इसे C से प्रदर्शित करते हैं।
स्थिर आयतन पर ऊष्मा धारिता (Cv)
स्थिर आयतन पर किसी गैसी के इकाई द्रवामान का ताप 1° बढ़ाने के लिए जितनी ऊष्मा की आवश्यकता पड़ती है उसे स्थिर आयतन पर उस गैस की ऊष्मा धारिता (Cv) कहते हैं।
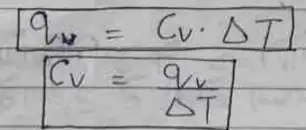
नोट: स्थिर आयतन पर किसी निकाय द्वारा अवशोषित ऊष्मा की मात्र उसकी आन्तरिक ऊर्जा के बराबर होती है।
qv = Cv△T = △E
स्थिर दाब पर ऊष्मा धारिता (Cp)
स्थिर दाब पर किसी गैस के इकाई द्रव्यमान का ताप 1°C बढ़ाने के लिए जितनी ऊष्मा की आवश्यकता होती है उसे स्थिर दाब पर उस गैस की ऊष्णा धारिता (Cp) कहते हैं।

Note स्थिर दाब पर अवशोषित उष्मा एन्थेल्पी के बराबर होती है।
ऊष्माक्षेपी अभिक्रियायें: वे अभिक्रियायें जिनमें ऊष्मा उत्सर्जित या उत्पन्न होती है ऊष्माक्षेपी अभिक्रियाएं कहलाती है।
ऊष्माशोषी अभिक्रियायें:- वे अभिक्रियायें जिनमें ऊष्मा अवशोषीत होती है ऊष्माशोषी अभिक्रियाएं कहलाती है।
Tagged with: chemistry chapter 6 class 11 notes in hindi | chemistry class 11 chapter 6 in hindi notes | class 11 chemistry chapter 6 ncert notes in hindi | Class 11 chemistry Chapter 6 Notes in Hindi | thermodynamics Notes in Hindi
What is the the system
6 chapters notes
Important question answer