यहाँ हमने Class 10 Science Chapter 4 Notes in Hindi दिये है। Class 10 Science Chapter 4 Notes in Hindi आपको अध्याय को बेहतर ढंग से समझने में मदद करेंगे और आपकी परीक्षा की तैयारी में सहायक होंगे।
Class 10 Science Chapter 4 Notes in Hindi
कार्बन कि विशेषताएँ :
- कार्बन का परमाणु क्रमांक 6 होता है। और इसे “C” से दर्शाते है।
- कार्बन की ज्यामिति सम चतुष्कफलकीय होती है।
- कार्बन की संयोजकता चार होती है एंव यह अपनी चारो संयोजकता को पूरी करने के लिए यौगिकों के साथ एकल, द्वि, एंव त्रिबंध बनाकर अणुओं का निर्माण करते है।
- कार्बन के तीन प्राकृतिक समस्थानिक 6C12, 6C13, 6C14
कार्बन में आबन्ध-सहसंयोजी आबन्ध :
आयनिक यौगिकों के अलावा अनेक ऐसे यौगिक भी होते हैं जिनके अणुओं के आयन नहीं होते है हाइड्रोजन, क्लोरिन आदि । इन सभी अणुओं के प्रत्येक परमाणु ऐसे रासायनिक आबंन्ध द्वारा जुडे होते है जिनकी उत्पत्ति आबन्धित परमाणुओं के मध्य एक या एक से अधिक संयोजकता इलेक्ट्रोनों की साझेदारी द्वारा सम्पन्न होती है।
हाइड्रोजन का अणु:- हाइड्रोजन की परमाणु संख्या एक है। अत: इसके K कोश में एक इलेक्ट्रॉन है तथा K कोश को भरने के लिए इसको एक और इलेक्ट्रॉन की आवश्यकता होती है। अत: हाइड्रोजन के दो परमाणु इलेक्ट्रोनों की साझेदारी करके हाइड्रोजन का अणु H2 बनाते है।

क्लोरीन का अणु:- क्लोरीन के एक अणु में दो क्लोरीन परमाणु होते हैं। दो क्लोरीन परमाणु अपने अष्टक को इलेक्ट्रोनों के एक युग्म की साझेदारी से पूर्ण करते है।
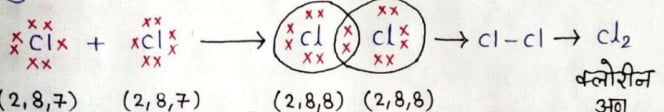
ऑक्सीजन का अणु:-
ऑक्सीजन अणु में दो ऑक्सीजन परमाणु एक दूसरे से आबन्ध करते समय दो-दो इलेक्ट्रोनों की सांझेदारी करके अपने अष्टक को पूर्ण करते है एवं द्वि: आबंन्ध बनाते है।

नाइट्रोजन का अणु:- नाइट्रोजन अणु में दो नाइट्रोजन के परमाणुओ के बीच एक त्रिबन्ध होता है क्योंकि नाइट्रोजन परमाणुओं का इलेक्ट्रॉनिक विन्यास (2,5) होता है। इन्हें अपना अष्टक पूर्ण करने के लिए तीन इलेक्ट्रोनों की आवश्यकता होती है।

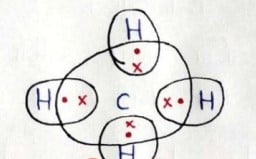
मीथेन का अणु:- मीथेन कार्बन का एक यौगिक है। ईंधन के रूप में मीथेन का बहुत अधिक उपयोग होता है। मीथेन का सुत्र CH4 है। इसमें कार्बन की संयोजकता 4 है। उत्कृष्ट गैस विन्यास की स्थिति को प्राप्त करने के लिए कार्बन इन इलेक्ट्रोनों की साझेदारी हाइड्रोजन के चार परमाणुओं के साथ करता है ।
सहसंयोजी आबन्ध:- दो परमाणुओं के बीच इलेक्ट्रॉन के एक युग्म की साझेदारी के द्वारा बनने वाले आबन्ध, सहसंयोजी आबन्ध कहलाते है।
गुण:-
- इनका अन्तराअणुक बल कम होता है।
- गलनांक एवं क्वथनांक कम होते है।
- विद्युत के कुचालक होते है।
कार्बन के अपररूप:
किसी तत्व के वे भिन्न रूप जिनके रासायनिक गुणधर्म एक समान होते है जबकि भौतिक गुणधर्म भिन्न-भिन्न होते है, ‘अपररूप” कहलाते है।
हीरा:-
- हीरे में कार्बन का प्रत्येक परमाणु के चार अन्य परमाणुओं के साथ आबंधित होकर एक ढृद त्रिआयामी चतुष्फलकीय संरचना का निर्माण करता है।
- यह कार्बन का अतिशुद्ध रूप है।
- यह विद्युत का कुचालक होता है।
- शुद्ध कार्बन को अत्यधिक उच्च दाब एवं ताप पर उपचारित करके हीरे को संश्लेषित किया जा सकता है।
ग्रेफाइट:-
- ग्रेफाइट काले धूसर रंग का मुलायम पदार्थ होता है।
- ग्रेफाइट चिकना तथा फिसलनशील पदार्थ होता है।
- यह चमकीला पदार्थ होता है।
- ग्रेफाइट विद्युत का सुचालक होता है।
फुलरीन:-
- फुलरीन की संरचना एक फुटबॉल की तरह होती है।
- अमेरिका के प्रसिद्ध वास्तुकार बकमिन्सटर फुलर के नाम पर इसका नाम फुलरीन रखा गया ।
- फुलरीन गोल गुम्बंद के समान लगते है।
- C60 सर्वाधिक स्थायी फुलरीन है जिसे बकमिन्स्टर फुलरिन भी कहते है।
संतृप्त यौगिक:- कार्बन परमाणुओं के बीच केवल एक आबन्ध से जुड़े कार्बन के यौगिक संतृप्त यौगिक कहलाते है।
असंतृप्त यौगिक:- द्विबन्ध अथवा त्रिबन्ध वाले कार्बन के यौगिक असंतृप्त यौगिक कहलाते है।
हाइड्रोकार्बन:- कार्बन तथा हाइड्रोजन से बने यौगिक हाइड्रोकार्बन कहलाते है। जैसे :- CH4, C2H6, C2H4, C2H2 इत्यादि ।
IUPAC पद्धति:- IUPAC का पूरा नाम ” International union Per of Applied chemistry” (अन्तर्राष्ट्रिय विशुद्ध और अनप्रयुक्त रसायन संब)
इस पद्धति के अनुसार सभी कार्बनिक यौगिकों का नामकरण किया जा सकता है। इस पद्धति के अनुसार कुछ सरल कार्बनिक यौगिक जैसे- एल्केन, एल्कीन, एल्काइन का नामकरण निम्नानुसार किया जाता है:-
- हाइड्रोकार्बन के नामकरण में कार्बनिक यौगिक के अणु में उपस्थित कार्बन परमाणुओं की संख्या के आधार पर उसका पूर्वलग्न लिखा जाता है।
- अणु में उपस्थित बन्ध के आधार पर उसका अनुलग्न लिखा जाता है।
- पूर्वलग्न व अनुलग्न को जोड़कर हाइड्रोकार्बन का पूरा नाम लिखा जाता है।
पूर्वलग्न का निर्धारण:-
| अणु में कार्बन परमाणु की संख्या | पूर्वलग्न |
|---|---|
| C1 | मेथ |
| C2 | ऐथ |
| C3 | प्रोप |
| C4 | ब्युट |
| C5 | पेन्ट |
| C6 | हेक्स |
| C7 | हेप्ट |
| C8 | ऑक्ट |
| C9 | नॉन |
| C10 | डेक |
अनुलग्न का निर्धारण:
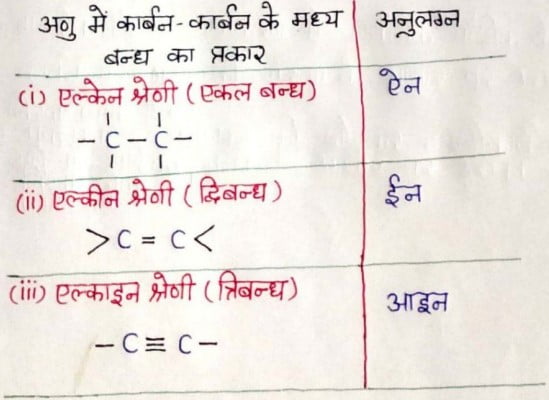
एल्केन का नामकरण:- इस श्रेणी के यौगिकों का सामान्य सूत्र CnH2n+2 होता है तथा इन्हें “संतृप्त यौगिक एंव पैराफिन्स” भी कहते है।
नामकरण के नियम :
सर्वाधिक लम्बी श्रृंखला का चयन किया जाता है। मुख्य श्रृंखला के बाहर रहे समूह को प्रतिस्थापी कहते है।
यदि दो या दो से अधिक समान लम्बाई की सर्वाधिक लम्बी श्रृंखलाएँ हो तो अधिक प्रतिस्थापी युक्त श्रृंखला का चयन किया जाता है।
नाम लिखते समय प्रतिस्थापियों का नाम सबसे पहले लिखा जाता है एंव उनके ” पूर्वलग्न ” का प्रयोग करते हुए अंग्रेजी वर्णमाला के क्रम में लिखते है।
प्रतिस्थापियों का अंकन: प्रतिस्थापियों को कम अंक दिए जाते है। यदि दो प्रतिस्थापियों को समान अंक मिल रहे हो तो अंग्रेजी वर्णमाला में पहले आने वाले प्रतिस्थामी को कम अंक दिया जाता है।
नाम लिखते समय अंको के मध्य ” कोमा” तथा अंक व नाम के मध्य “हाइफन ” का प्रयोग करते है।
यदि एक से लिए नीचे दी अधिक समान प्रतिस्थायी हो तो उनकी संख्या दर्शाने के गई सारणी अनुसार लिखते है।
| एक | मोनो |
| दो | डाई |
| तीन | ट्राई |
| चार | टेट्रा |
| पांच | पेंटा |
| छ: | हेक्सा |
| सात | हेप्टा |
| आठ | ऑक्टा |
| नो | नोना |
| दस | डेका |
कार्बन तथा हाइड्रोजन के संतृप्त यौगिकों के सूत्र तथा संरचनाएँ :

एल्कीन का नामकरण:- इस श्रेणी के यौगिकों का सामान्य सूत्र CnH2n है। इन यौगिकों में कार्बन-कार्बन के मध्य द्विबन्ध पाया जाता है। अतः सर्वाधिक छोटे एल्कीन में कम से कम दो कार्बन उपस्थित रहेंगे। ये असंतृप्त हाइड्रोकार्बन कहलाते है।
नामकरण के नियम:
- कार्बन की द्विबन्ध युक्त सबसे लम्बी श्रृंखला का चयन किया जाता है। इसे मुख्य श्रृंखला कहते है।
- मुख्य कार्बन श्रृंखला का अंकन उस दिशा से करते है जिधर से द्विबन्ध को कम अंक मिले।
- अन्य नियम एल्केन के नामकरण के अनुसार होते है।

एल्काइन का नामकरण :
- इनका सामान्य सूत्र CnH2n+2 होता है ।
- इनको भी असंतृप्त हाइड्रोकार्बन कहा जाता है।
- इन यौगिकों में कार्बन-कार्बन के मध्य त्रिबंध पाया जाता है।
- इस श्रेणी का लघुतम सदस्य भी दो कार्बन का होता है।
- इस श्रेणी का अनुलग्न- ‘आइन’ होता है।
नामकरण के नियम :
- कार्बन की त्रिबन्ध युक्त सबसे लम्बी श्रृंखला का चयन किया जाता है। इसे मुख्य श्रृंखला कहते है।
- मुख्य कार्बन श्रृंखला का अंकन उसे छोर से करते है जिधर से त्रिबन्ध को कम अंक मिले ।
- यदि श्रृंखला में एक से अधिक त्रिबन्ध हो तो क्रमश: डाई, ट्राई इत्यादि शब्दों का प्रयोग उनकी संख्या को दर्शाने के लिए करते हैं।
समजातीय श्रेणी:- यौगिकों की ऐसी श्रृंखला जिसमें कार्बन श्रृंखला में स्थित हाइड्रोजन को एक ही प्रकार का प्रकार्यात्मक समूह प्रतिस्थापित करता है। समजातीय श्रेणी कहलाती है।
कार्बन यौगिकों की नाम पद्धत्ति :
प्रकार्यात्मक समूह की प्रकृति के आधार पर “पूर्वलग्न” या “अनुलग्न ” के के द्वारा संशोधित करके यौगिकों का नाम उनकी कार्बन श्रृंखलाओं पर आधारित होता है|
नामकरण के नियम:-
- यौगिक में कार्बन परमाणुओं की संख्या ज्ञात करें।
- प्रकार्यात्मक समूह की उपस्थिति में इसको पूर्वलग्न अथवा अनुलग्न के साथ यौगिक के नाम में दर्शाया जाता है।
प्रकार्यात्मक समूहों को निम्न प्रकार समझा जा सकता है।
( i ) हैलोजन:- यदि कार्बन श्रृंखला में प्रकार्यात्मक समूह हैलोजन है, तो यहाँ पूर्वलग्न क्लोरो, ब्रोमो, आयोडो इत्यादि लगता है।
CH3Cl → क्लोरोमीथेन
CH3 – CH2 – CH2 – CH2 – Br → ब्रोमोब्यूटेन
(ii) एल्कोहॉल:- यदि कार्बन श्रृंखला में प्रकार्यात्मक समूह एल्कोहॉल – OH उपस्थित है, तो यहाँ अनुलग्न (01) लगाते है।
- CH3 – CH2 – OH → ऐथेनॉल
- CH3 – CH2 – CH2 – CH2 – CH2 – O – OH → पेन्टेनॉल
(iii) ऐल्डिहाइड:- यदि कार्बन श्रृंखला में प्रकार्यात्मक समूह ऐल्डिहाइड – CHO उपस्थित है, तो यहाँ अनुलग्न एल (al) लगाते है ।
CH3 – CHO → एथेनैल
CH3 – CH2 – CH2 – CHO→ ब्यूटेनैल
(iv) कीटोन:- यदि कार्बन श्रृंखला में प्रकार्यात्मक समूह कीटोन उपस्थित हो, तो यहाँ अनुलग्न “ओन” लगाते है।
CH3 – CH2 – CO- CH3 → ब्यूटेनोन
(V) कार्बोक्सिलिक अम्ल:- कार्बन श्रृंखला में प्रकार्यात्मक समूह कार्बोक्सिलिक अम्ल उपस्थित हो, तो यहाँ अनुलग्न “ओइक” अम्ल लगाते है।

(vi) द्विआबन्धित हाइड्रोकार्बन:- यदि हाइड्रोकार्बनों में द्विआबन्ध उपस्थित होता है तो ऐसे हाइड्रोकार्बनों को ऐल्कीन कहते है। इसमें अनुलग्न ईन लगता है।
उदाहरण:
CH2 = CH2 → एथीन
CH3 – CH2 – CH2 – CH = CH2 → पैन्टीन
कार्बनिक यौगिकों के रासायनिक गुणधर्म :
(i)दहन:- कार्बन तथा अन्य हाइड्रोकार्बन ऑक्सीजन के साथ दहन करने पर उष्मा, प्रकाश एंव कुछ यौगिक बनाते है। जैसे- कार्बन दहन करने पर कार्बनडाई ऑक्साइड तथा अन्य हाइड्रोकार्बन कार्बनडाई ऑक्साइड एंव जल बनाते है ।
C + O2 → CO2 + उष्मा व प्रकाश
CH4+2O2 → CO2+ H2O+ उष्मा व प्रकाश
(ii) ऑक्सीकरण:- दहन करने पर कार्बन यौगिकों को सरलता से ऑक्सीकृत किया जा सकता है। पूर्ण ऑक्सीकरण के अतिरिक्त ऐसी अभिक्रियाएँ भी होती है जिनमें एल्कोहॉल को कार्बोक्सिलिक अम्ल में बदला जा सकता है।

ऑक्सीकारक:- कुछ पदार्थों में अन्य पदार्थों को ऑक्सीजन देने की क्षमता होती है। इन पदार्थों को ऑक्सीकारक कहा जाता है।
पोटैशियम परमैंगनेट = KMnO4
पोटैशियम डाई क्रोमेट = K2Cr2O7
(iii) संकलन अभिक्रिया:- इस अभिक्रिया में असंतृप्त हाइड्रोकार्बन को पैलेडियम अथवा निकिल जैसे उत्प्रेरकों की उपस्थिति में जोड़कर संतृप्त हाइड्रोकार्बन बनाते है । उत्प्रेरक के कारण प्रक्रिया की गति तीव्र हो जाती है लेकिन यह अभिक्रिया की रासायनिक क्रिया को प्रभावित नहीं करते है।

निकल उत्प्रेरक का उपयोग:- वनस्पति तेलों को वनस्पति घी मे बदलने के लिए निकल उत्प्रेरक का उपयोग करते हैं।
(iv) प्रतिस्थापन अभिक्रिया:- संतृप्त हाइड्रोकार्बन अत्यन्त अनभिक्रित होते है। सूर्य के प्रकाश की उपस्थिति में अति तीव्र अभिक्रिया में क्लोरिन का हाइड्रोकार्बन में संकलन होता है। क्लोरिन एक-एक करके हाइड्रोजन के परमाणुओं का प्रतिस्थापन करती है। इसको प्रतिस्थापन अभिक्रिया कहते है ।

कुछ महत्वपूर्ण कार्बनिक यौगिक :
(i) एथेनॉल:- ऐथेनॉल के मुख्य गुणधर्म निम्न प्रकार से है।
ऐथेनॉल के भौतिक गुण:-
- शुद्ध एथेनॉल एक रंगहीन द्रव होता है। इसे एल्कोहॉल भी कहते है।
- यह एक अच्छा विलायक है। इसलिए इसका उपयोग टिंचर आयोडीन, कफ सीरप, टॉनिक आदि औषधियों में होता है।
- ऐथेनॉल को किसी भी अनुपात में जल में मिलाया जा सकता है।
- इसका गलनांक 156K जबकि क्वथनांक 351K होता है।
ऐथेनॉल के रासायनिक गुणधर्म :
(i) दहन:- ऐथेनॉल वायु में नीली लौ के साथ जलकर कार्बन डाई ऑक्साइड तथा जल बनाता है।

(ii) पोटैशियम परमैंगनेट के साथ अभिक्रिया:- पोटैशियम परमैंगनेट (KMnO4) ऐथेनॉल को ऐथेनॉइक अम्ल में ऑक्सीकृत कर देता है।

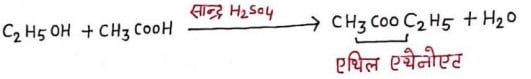
(iii) ऐथेनॉइक अम्ल से क्रिया:- ऐथेनॉल तथा ऐथेनॉइक अम्ल, सान्द्र सल्फ्यूरिक अम्ल की उपस्थिति में अभिक्रिया करके एथिल ऐथेनोएट एंव जल प्रदान करते है। ऐल्कोहल तथा सल्फ्यूरिक अम्ल की परस्पर अभिक्रिया के फलस्वरूप जो यौगिक निर्मित होते है। उन्हें एस्टर कहते है तथा इस अभिक्रिया को एस्टरीकरण कहते है ।
(iv) सोडियम से क्रिया:- ऐल्कॉहल सोडियम से अभिक्रिया करके हाइड्रोजन गैस उत्सर्जीत करता है। अभिक्रिया के पश्चात सोडियम एथॉक्साइड का निर्माण होता है ।

(II) ऐथेनॉइक अम्ल :
ऐथेनॉइक अम्ल के भौतिक गुणधर्म
- एथेनॉइक अम्ल को ऐसीटिक अम्ल कहा जाता है। तथा यह कार्बोक्सलिक अम्ल के समूह से सम्बन्ध रखता है। ऐसीटिक अम्ल के 3-4% विलयन को सिरका कहते है। शुद्ध ऐथेनॉइक अम्ल का गलनांक 290K होता है।
- एथेनॉइक अम्ल जल में विभिन्न अनुपातों में घोला जा सकता है।
- यह रंगहीन एवं तीक्ष्ण गन्ध वाला होता है।
ऐथेनॉइक अम्ल के रासायनिक गुणधर्म :
(i) एस्टरीकरण अभिक्रिया:– ऐथेनॉइक अम्ल किसी अम्ल उत्प्रेरक की उपस्थिति में परिशुद्ध ऐथेनॉल से अभिक्रिया करके एस्टर बनाते है ।

(ii) क्षारक के साथ अभिक्रिया:- खनिज अम्ल की भाँति ऐथेनॉइक अम्ल सोडियम हाइड्रॉक्साइड (NaOH) से अभिक्रिया करके सोडियम ऐथेनोएट बनाता है|
NaOH + CH3COOH → CH3COONa + H2O
(iii) कार्बोनेट एंव हाइड्रोजन कार्बोनेट के साथ अभिक्रिया:- ऐथेनॉइक अम्ल, कार्बोनेट एंव सोडियम हाइड्रोजन कार्बोनेट से क्रिया करके लवण, कार्बन डाई ऑक्साइड व जल बनाता है। इस अभिक्रिया में उत्पन्न लवन को सोडियम ऐसीटेट कहते है ।
2CH3COOH + Na2CO3 → 2 CH3COONa + H2O
CH3COOH + NaHCO3 → CH3COONa + H2O
साबुन और अपमार्जक
साबुन:- साबुन बहुत पुराने अपमार्जक है, जिन्हें तेल तथा वसा को क्षार द्वारा जल अपघटन करके बनाया जाता है। इस अभिक्रिया में साबुन उच्च वसा अम्लों जैसे- स्टीयरिक अम्ल, ओलिक अम्ल तथा पामिटिक अम्लों के सोडियम अथवा पोटैशियम लवण तथा ग्लिसरीन बनते है । इस क्रिया को साबुलीकरण कहते है।
(Note 🙂 साबुन कोलॉइडी अवस्था में रहता है। सोडियम तथा पोटैशियम लवण (साबुन) जल में विलेय होने के कारण इनका उपयोग स्वच्छीकारक क्रिया में किया जाता है। सोडियम साबुनों की तुलना में पोटैशियम साबुन त्वचा के लिए कोमल होते है। तथा जल में अधिक विलेय होते हैं। इसी कारण शेविंग क्रीम, शैम्पू तथा नहाने का साबुन बनाने में पोटैशियम लवणों का उपयोग करते है।
अपमार्जक:- अपमार्जक वे शोधन अभिकर्मक होते हैं जिनमें साबुन के सभी गुण होते है। परन्तु जो वास्तव में साबुन नहीं होते है। यह मृदु तथा कठोर दोनों प्रकार के जल में प्रयुक्त किये जाते है। ये बर्फीले जल में भी झाग देते है। इन्हें साबुनविहीन साबुन भी कहते हैं। ये ठोस, द्रव, पाऊडर आदि सभी रूपों में पाए जाते हैं।
मिसेल:- साबुन जैसे- सोडियम स्टियरेट में मिसेल का बनना इस प्रकार है-
सर्वप्रथम सोडियम स्टियरेट अनुओं का जल में आयनन होता है-
C17H35COO-Na+ → C17H35COO- + Na+
आयनन से प्राप्त ऋणायनों को हम निम्न प्रकार से लिख सकते है।

यहाँ हाइड्रोकार्बन भाग अर्थात C17H35 इस कण की पूँछ तथा धुव्रिय भाग ( -COO-) सिर कहलाता है। इस प्रकार अणुओं का द्रव स्नेही तथा द्रव विरोधी भाग परस्पर जुड़कर एक व्यववस्थित रूप में इक्टठे होकर मिसेल का निर्माण करते है।
साबुनों की शोधन क्रिया:- मिसेल में एक जल विरोधी हाइड्रोजन का केन्द्रीय क्रोड होता है। साबुन के द्वारा शोधन क्रिया में के साबुन अणु तेल की बूंदों के चारों ओर इस प्रकार से मिशेल बनाते है कि स्टिएरेट आयन का जल विरागी भाग बूंदों के अन्दर होता है एंव जलरागी भाग चिकनाई की बूंदों के बाहर काँटों की तरह निकला रहता है। अत: स्टिएरेट आयनों से घिरी हुई तेल की बूंदे जल में खिंच जाती है एवं गन्दगी सतह से हट जाती है। इस प्रकार साबुन तेलों एवं वसाओं का पायसीकरण છત करके धुलाई में सहायता करता है |
मिसेल के रूप में साबुन स्वच्छ करने में सक्षम होता है क्योंकि तैलीय मैल मिसेल में एकत्र हो जाता है। मिसेल विलयन में कोलाइड के रूप में बने रहते है। तथा आयन- आयन विकर्षण के कारण वे अविक्षेपित नहीं होते है। इस प्रकार मिसेल में तैरते मैल को आसानी से हटाया जा सकता है। साबुन के मिसेल प्रकाश को प्रकीर्णित कर सकते है। यही कारण है कि साबुन का घोल बादल जैसा दिखता है।
Chapter 1: रासायनिक अभिक्रियाएँ एवं समीकरण
Chapter 2: अम्ल, क्षारक एवं लवण
Chapter 3: धातु एवं अधातु
Tagged with: carbon and its compounds notes in Hindi | class 10 science chapter 4 ncert notes in hindi | Class 10 science Chapter 4 Notes in Hindi | science chapter 4 class 10 notes in hindi | science class 10 chapter 4 in hindi notes