यहाँ हमने Class 10 Science Chapter 1 Notes in Hindi दिये है। Class 10 Science Chapter 1 Notes in Hindi आपको अध्याय को बेहतर ढंग से समझने में मदद करेंगे और आपकी परीक्षा की तैयारी में सहायक होंगे।
Class 10 Science Chapter 1 Notes in Hindi
रासायनिक समीकरण:- किसी रासायनिक अभिक्रिया को अभिकारकों एव उत्पादों के प्रतीकों व रासायनिक सूत्रों का प्रयोग करके प्रदर्शित करना रासायनिक समीकरण कहलाता है ।
जैसे :- ZN + H2SO4 → ZNSO4 + H2
अभिकारक:- ऐसे पदार्थ जो रासायनिक अभिक्रिया में भाग लेते है। अभिकारक कहलाते है। जैसा:-

उत्पाद:- ऐसे पदार्थ जो रासायनिक अभिक्रिया के सम्पूर्ण होने पर प्राप्त होते है। उत्पाद कहलाते है।

सन्तुलित रासायनिक समिकरण:- वह रासायनिक समिकरण जिसमें विभिन्न तत्वों के परमाणुओं की संख्या अभिकारक व उत्पाद दोनो पक्षों में समान होती है। सन्तुलित रासायनिक समिकरण कहलाता है।
जैसे:
- 3Fe + 4H2O →Fe3O4 + 4H2
- 2H2 + O2 → 2H2O
रासायनिक अभिक्रियाओं के प्रकार:- रासायनिक अभिक्रियाएँ निम्न प्रकार प्रकार की होती है।
- संयोजन अभिक्रियाँ / संयुग्मन अभिक्रियाँ | योगात्मक अभिक्रियाँ
- उष्माक्षेपी अभिक्रियाँ
- उष्माशोषी अभिक्रियाँ
- विस्थापन अभिक्रियाँ
- द्विविस्थापन अभिक्रियां
- उपचयन अभिक्रियाँ / ऑक्सीकरण अभिक्रियाँ
- अपचयन अभिक्रियाँ
- रेडॉक्स अभिक्रियाँ / उपचयन- अपचयन अभिक्रियाँ
संयोजन अभिक्रियाँ:- इस अभिक्रियाँ में दो या दो से अधिक अभिकारक मिलकर एकल उत्पाद का निर्माण करते है। ऐसी अभिक्रियाँ को संयोजन अभिक्रियाँ कहते है।
उदाहरण:-
- कोयले का दहन:- C + O2
- जल का निर्माण:-2H2 + O2 → 2H2O
- गन्धक का दहन:- S + O2 → SO2
- कैल्सियम हाइड्रॉक्साइड का निर्माण : CaO + H2O → Ca(OH)
वियोजन अभिक्रिया:- वह अभिक्रिया जिसमें एकल अभिकर्मक टुटकर दो या दो से अधिक उत्पाद बनाता है। उसे वियोजन अभिक्रिया कहते है। उदाहरण:
- फेरस सल्फेट की वियोजन अभिक्रिया:- 2FeSO4 → Fe2O3 + SO2 + SO3
- कैल्सियम कार्बोनेट की वियोजन अभिक्रिया:- CaCO3 → CaO + CO2
- सिल्वर ब्रोमाइड भी एक प्रकार की वियोजन अभिक्रिया है: 2AgBr → 2Ag + Br2। इस अभिक्रिया का उपयोग श्याम – श्वेत फोटोग्राफी में किया जाता है।
उष्माक्षेपी अभिक्रियाँ:- वह अभिक्रियाँ जिसमें उष्मा ऊर्जा के रूप में उत्सर्जीत होती है। उसे उष्माक्षेपी अभिक्रियाँ कहते है।
उदाहरण:
- प्राकृतिक गैस का दहन: CH4 + 2O2 → CO2 +2H2O + ऊर्जा
- श्वसन एक उष्माक्षेपी अभिक्रियाँ है:- मनुष्य को जीवित रहने के लिए हमें ऊर्जा की आवश्यकता होती है। यह ऊर्जा हमें भोजन से प्राप्त होती है। पाचन क्रिया के समय खाद्य पदार्थो मे टूट जाते है। जैसे चावल, आलू तथा ब्रेड में कार्बोहाइड्रेट होता है। कार्बोहाइड्रेट के टूटने से ग्लूकोज प्राप्त होता है। यह ग्लूकोज हमारे शरीर की कोशिकाओं में उपस्थित ऑक्सीजन से मिलकर हमें ऊर्जा प्रदान करता है। इस अभिक्रिया का नाम श्वसन है। C6H12O6 +6O2 → 6CO2 + 6H2O+ ऊर्जा
- शाक – सब्जियों का विघटित होकर कंपोस्ट बनना भी ऊष्माक्षेपी अभिक्रिया का उदाहरण है।
उष्माशोषी अभिक्रियाँ:- जिन अभिक्रियाओं में ऊर्जा का अवशोषण होता है। उसे उष्माशोषी अभिक्रिया कहते है।
उदाहरण:
- H2 + I2 + ऊर्जा → 2HI
- N2 + O2 + ऊर्जा → 2NO
विस्थापन अभिक्रिया:- ऐसी अभिक्रियाँ जिसमें किसी यौगिक के अणु के किसी एक परमाणु अथवा समूह के स्थान पर कोई दूसरा परमाणु अथवा समूह आ जाता है। विस्थापन अभिक्रियाँ कहलाती है।
उदाहरण:
- ZN + CuSO4 →ZNSO4 + Cu
- Fe +CUSO4 → FeSO4 + Cu
द्विविस्थापन अभिक्रियाँ:- वे अभिक्रियाएँ जिनमें अभिकारकों के बीच आयनों का आदान प्रदान होता है। द्विविस्थापन अभिक्रियाएँ कहलाती है।
उदाहरण:
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
उपचयन अभिक्रियाएँ:- ऐसी अभिक्रियाँ जिसमें ऑक्सीजन की वृद्धि हो तथा हाइड्रोजन का त्याग हो उसे उपचयन अभिक्रिया कहते है।
उदाहरण:
- 2Mg+ O2 →2MgO
- 2CU + O2 → 2CuO
अपचयन अभिक्रियाँ:- ऐसी अभिक्रियाँ जिसमें हाइड्रोजन की वृद्धि हो तथा ऑक्सीजन का त्याग हो उसे अपचयन अभिक्रिया कहते हैं । उदाहरण:
CuO + H2 → Cu+ H2O
रेडॉक्स अभिक्रियाएँ:- जिन रासायनिक अभिक्रियाओं में उपचयन तथा अपचयन अभिक्रियाएँ साथ-साथ होती है। रेडॉक्स अभिक्रियाएँ कहलाती है।
उदाहरण:
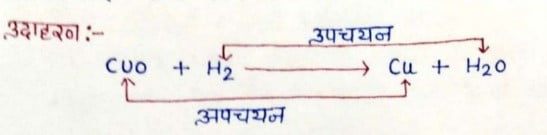
दैनिक जीवन में उपचयन अभिक्रियाओं के प्रभाव :
संक्षारण:- जब कोई धातु अपने आसपास अम्ल, आर्द्रता आदि के सम्पर्क में आती है। तब ये संक्षारित होती है। इस प्रक्रिया को संक्षारण कहते है।
उदाहरण:- चाँदी के ऊपर काली पर्त, ताँबे के ऊपर हरी पर्त चढ़ना, लोहे पर जंग लगना
विकृतगंधिता:- तेल व वसा के उपचयित हो जाने पर ये विकृतगन्धी हो जाते है। तथा इनकी गन्ध व स्वाद में परिवर्तन हो जाता है। इनमें प्रतिऑक्सीकारक मिलाकर अथवा भोज्य पदार्थों को निर्वातित पात्रों में रखकर अथवा इनमें नाइट्रोजन प्रवाहित करके इस प्रक्रिया को रोका जा सकता है।
उदाहरण:- आलू की चिप्स की थैलियों में नाइट्रोजन प्रवाहित करके इन्हें उपचयित होने से बचाया जा सकता है।
Check:- Class 10 Science Notes in Hindi
- 10th Class Science Objective Questions in Hindi (Pdf Download) 2023
- Class 10 Chemistry Objective Question in Hindi pdf 2023
- Class 10 Math Objective Question in Hindi pdf 2023
- Class 10 Social Science Objective Question in Hindi pdf 2023
Tagged with: chemical reaction and equation notes in Hindi | class 10 science chapter 1 ncert notes in hindi | Class 10 science Chapter 1 Notes in Hindi | science chapter 1 class 10 notes in hindi | science class 10 chapter 1 in hindi notes