यहाँ हमने Class 12 Chemistry Chapter तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम Notes in Hindi दिये है। Class 12 Chemistry Chapter तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम Notes in Hindi आपको अध्याय को बेहतर ढंग से समझने में मदद करेंगे और आपकी परीक्षा की तैयारी में सहायक होंगे।
तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम Notes in Hindi
खनिज: धातुओ के वे यौगिक जिन्हें पृथ्वी की परतो से खनन द्वारा प्राप्त किया जाता है। खनिज कहलाते है।
अयस्क: वे खनिज जिनसे धातुओं का निष्कर्षण आसानी से कम खर्च मे तथा अधिक मात्रा में प्राप्त हो सके, अयस्क कहलाते है।
आघात्री / गैंग / मैट्रिक्स:- अयस्क में उपस्थित अवांछनीय पदार्थो को अधात्री / गैंग / मैट्रिक्स कहते है।
धातुक्रम:- वह विधि जिसमें अयस्क द्वारा धातु निष्कर्षण विभिन्न चरणो मे किया जाता है, धातुक्रम कहलाते है।
गालक:- वह पदार्थ जो प्रगलन के समय वाल्या मट्टी मे अम्लीय या क्षारीय अशुद्धियो को दूर करने के लिए मिलाया जाता है। गालक कहलाते है।
गालक अमलनीय अशुद्धियो को गलनीय धातुमल में परिवर्तित करता है।
अम्लीय अशुद्धियो को दूर करने के लिए क्षारीय गालक जबकि क्षारीय अशुद्धियों को दूर करने के लिए अम्लीय गालक काम में लिए जाते है।
अम्लीय गालक के उदाहरण :
SiO2, P2O5
क्षारीय गालक के उदाहरण :
CaO, MgO, FeO आदि ।
धातुमल(slag):- आधात्री + गालक = धातुमल
धातुमल का घनत्व एवं गलनांक धातुओ से कम होता है। कम घनत्व के कारण धातुमल गलित धातु के ऊपर एक रक्षित परत बनाकर धातु ऑक्सीकृत होने से रोकते है।
मैट:- प्रगलन के पश्चात प्राप्त अशुद्ध धातु मैट कहलाती है।
धातु का निष्कर्षण:- धातु का निष्कर्षण निम्न चार पदो मे होता है।
- अयस्क का सान्द्रण
- भर्जन एवं निस्तापन
- अपचयन
- शोधन
अयस्क का सान्द्रण :-
अवांछित पदार्थो Ex:- रेत, क्ले आदि का अयस्को से निष्कासन का प्रक्रम अयस्क सान्द्रण , प्रसाधन सब्जीकरण कहलाता है
- गुरुत्वीय पृथक्करण विधि:- Fe2O3 + SnO2
- चुम्बकीय पृथक्करण:- Fe3O4
- रासायनिक पृथक्करण विधि:- निक्षालन Ex:- Al, Au, Ag
- झाग प्लवन विधि / फेन प्लवन विधि:- सल्फाइड अयस्को को आधात्री से मुक्त करना
- संग्राही:- चीड़ का तेल, वसा तेलअम्ल, जन्येट, तारपीन का तेल आदि
- फेनस्थायीकारी:- क्रिसॉल, एनिलीन
भर्जन एवं निस्तापन:-
भर्जन:- सल्फाइड़ अयस्को को वायु की उपस्थिति में गर्म करके ऑक्साइड मे परिवर्तित करना।
2ZnS +3O2 → 2ZnO +2SO2
निस्तापन:-
हाइड्रोक्साइड कार्बोनेट तथा जल योजित ऑक्साइड अयस्क को वायु की अनुपस्थिति मे गर्म करने पर जल एवं CO2 त्यागने पर ऑक्साइड मे परिवर्तित होते है।
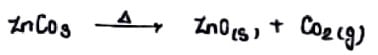
अपचयन:-
धातु ऑक्साइड का धातु मे अपययन
- रासायनिक अपचयन:
- कार्बन द्वारा अपचयन (Zn, Pb, Sn)
- एलुमिनो तापीय अपचयन (MnO2, FeO, Cr2O3)
- स्वअपचयन: (Cu, Pb के लिए)
- CuS + O2 → Cu2O + SO2↑
- Cu2S + Cu2O → Cu +SO2↑
- विद्युत अपघटनीय अपचयन :
- उच्च विद्युतधनी धातु :- NA, K, Ca आदि
- धातु विस्थापन विधि:- (Cu, Au, Ag)
- द्रवण: ऐसे धातु जिनका अशुद्धियो से कम गलनाक होता है। (SN, Pb, Bi)
- आसवन:- इसमे वाष्पशील धातुओं का शोधन किया जाता है। (Zn, Cd, Mg )
- ऑक्सीकरण:- Pb का शुद्धिकरण
- विद्युत अपघटनी:- Cu, Ai, Ag, Au, Sn आदि
- वितरण विधि
- क्षेत्रीय शोधन / मण्डल परिष्करण : यह विधि मुख्य रूप से अति उच्च शुद्धता वाले अर्द्धचालको तथा अन्य अतिशुद्ध धातुओ – Si, B, In आदि को प्राप्त करने की उपयुक्त विधि है।
- वाष्प प्रवस्था परिष्करण : इसमे दो विधिया सम्मिलित है।
- माण्ड विधि: निकल का शोधन
- वान आरकैल:- Zs, Ti का शोधन
- भूपर्पटी मे सबसे अधिक पाये जाने वाली दूसरी धातु लोहा (आयरन ) है ।
- भूपर्पटी में सर्वाधिक पाये जाने वाला तीसरा तत्व एल्युमिनियम है।
एल्युमिनियम के उपयोग:-
- चॉकलेट के रैपर मे ।
- क्रोमियम एवं मैग्नीज के ऑक्साइडो से उनके निष्कर्षण मे तारो का उपयोग विद्युत चालन मे ।
ताँबे का उपयोग:
- पीतल (Zn एवं Cu का मिश्रण)
- कांसा ( टिन एवं Cu का मिश्रण)
- तार बनाने मे
- जल एवं भाप के लिए पाइप बनाने मे
जिंक (Zn) के उपयोग:-
- जस्तेदार लोहा बनाने मे
- बैटरियो मे
- कई मिश्र धातु जैसे- पीतल (Cu 60%, Zn 40%), जर्मन सिल्वर (Cu 25-30%, Zn 25-30%, Ni 40-50% )
लोहे के उपयोग:-
- ढलवा लोहे का उपयोग:- रेलवे स्लिपरो, गटर पाइपो तथा खिलौनो मे ।
- NOTE:→ (i) लोहे का सबसे महत्वपूर्ण प्रकार ढलवा लोहा है।
- इसका उपयोग पिटवा लोहा तथा इस्पात बनाने में होता है।
- पिटवा लोह के उपयोग: कृषि उपकरणो मे, चैनो, वोल्ट तारो आदि मे
निकल-इस्पात के उपयोग:
रस्सी बनाने मे, स्वचालित वाहनो, हवाईजहाजो के हिस्सो मे, मापक फीतो मे, कटाई के औजार मे ।
स्टेनलेस स्टील के उपयोग:
बर्तनो मे, पैनो मे, साइकिल मे।
बॉक्साइट अयस्क से एलुमिना का निक्षालन:-
बॉक्साइट अयस्क मे अधिकाशतः सिलिका, आयरन, ऑक्साइड तथा ट्राइटेनियम ऑक्साइड की अशुद्धिया होती है। बॉक्साइट अयस्क को सोडियम हाइड्रोक्साइड के साथ जल की उपस्थिती मे गर्म किया जाता हैं। इस प्रकार Al2O3 सोडियम एलुमिनेट के रूप मे एवं (सिलिक) (SiO2) सोडियम सिलिकेट के रूप मे निक्षालित हो जाती है तथा अशुद्धिया शेष रह जाती है ।
Al2O3(s) + 2NaOH(aq) + 3H2O(l) → 2Na[Al(OH)4](aq)
जिससे △G का मान ऋणात्मक प्राप्त होता है। किसी अभिक्रिया के लिए इस प्रकार के परिवर्तनों को निम्न समी० के द्वारा दर्शाया जा सकता है |
△Go = -RTlnK
△Go = -2.303RTlogK
K = ताप T पर अभिक्रिया का साम्य स्थिराक
समीकरण मे यदि साम्य स्थिरांक (K) का मान धनात्मक हो तो △G का ऋणात्मक आयेगा । जिससे यह अभिक्रिया स्वत परिवर्तित होगी अर्थात् अग्र दिशा में सम्पन्न होगी।
एलिंघम आरेख:-
कुछ ऑक्साइडो के विरचन को △Go और T के मध्य ग्राफ के रूप में प्रदर्शित किया जाए तो उस ग्राफ को एलिंघम आरेख कहते हैं।
NOTE:- एलिंघम आरेख मे हमेशा △Go का मान ऋणात्मक लिया जाता है।
एलिंघम आरेख के उपयोग :
- ऑक्साइडो के अपचयन के लिए उचित अपचयन मे सहायक है।
- किसी अयस्क के ऊष्मीय अपचयन होने की सम्भावना व्यक्त करते है।
अलिंघम आरेख की उपयोगिताऐ:-
जैसे अभिक्रिया:-
2xMs + O2(g) → 2MxOs
इस अभिक्रिया मे सामान्यतः बाँये से दाये जाने पर गैस की मात्रा मे या उनके अणुओं की धावृहिकता में कमी होती है। जिससे एन्ट्रापी के मान मे कमी होती है एवं कमी को ऋणात्मक चिन्ह द्वारा प्रदर्शित कर सकते है।
हेल्म हॉन्टेज समी० से –
△G =△H – T△S
विलयन मे CO2 gas प्रवाहित कर एलुमिनेट को उदासीन कर लिया जाता है एवं जलयोजित Al2O5 अवक्षेपित हो जाता है ।
2 Na[Al(OH)4](aq) + CO2(g) → Al2O3.xH2O(s) + 2NaHCO3
सोडियम सिलिकेट विलयन में शेष रह जाता है तथा जलयोजित एलुमिना को छानकर सूखाकर एवं गर्म करके पुनः शुद्ध Al2O3 प्राप्त कर लिया जाता है।
चाँदी एवं सोने का निक्षालन:-
चाँदी एवं सोने के धातुक्रम में धातुओ का निक्षालन वायु की उपस्थिति मे NaCN एवं KCN के तनु विलयनो द्वारा किया जाता है। जिससे धातु बाद मे प्रतिस्थापन द्वारा प्राप्त कर ली जाती है ।
4M(s) + 8CN–(aq) + 2H2O(aq) +O2(g) → 4[M(CN)2]–(aq) +4OH–(aq)
2[M(CN)2]–(aq) + ZN(s) → [Zn(CN)4]-2(aq) + 2M(s)
धातुगतिकी के ऊष्मागतिकी सिद्धान्त:-
इसको समझने के ऊष्मागतिकी की गिब्ज़ हेल्म हॉल्टेज समीकरण काम मे ली जाती है।
△G =△H – T△S
△G = गिब्ज मुक्त ऊर्जा में परिवर्तन
△H = एन्थैल्पी परिवर्तन
△S = एन्ट्रॉपी परिवर्तन
समीकरण से निष्कर्ष निकलता है कि △G का मान ऋणात्मक हो तो यह अभिक्रिया अग्र दिशा मे सम्पन्न होगी। जिसके लिए △H एवं △S के मान धनात्मक होने चाहिए साथ ही △S के मान △H के मान की तुलना में अधिक धनात्मक होने चाहिए। इसके लिए हमे △S के मान में वृद्धि हो जाती है।
अतः △H<T△S
यहाँ △S ऋणात्मक होने के कारण इस समीकरण मे T△S का मान धनात्मक हो जाता है। अत: ताप में वृद्धि के साथ अब इस अभिक्रिया के △G का मान बढ़ता जाता है। अर्थात् MxO(s) के विरचन की अधिकांश अभिक्रिया के वक्रो का ढाल धनात्मक होगा ।
वक्र मे एक ऐसा बिन्दु जिसके नीचे △G ऋणात्मक है। इस बिन्दु के ऊपर MxO स्वयं विघटित हो जाएगा ।
अलिंघम आरेख की सीमाए:-
इन आरेख से किसी अभिक्रिया के सम्भव होने या ना होने की पुष्टि होती है। अर्थात् अपचायक के साथ अपचयन की प्रवृर्ति प्रदर्शित करती है।
- यह अपचयन प्रक्रमो की बलगतिकी के बारे में कुछ नहीं बताती।
- △G की व्याख्या के △Go = -2.303RTlogK पर आधारित है। अर्थात इससे यह माना गया कि अभिकारक और उत्पाद साम्यावस्था में होते है।
| धातु | अयस्क | संघटन |
|---|---|---|
| ऐलुमिनियम | बॉक्साइट केथोलिनाइट | AlOx(OH)3.2x [Al2(OH)4Si2O3] |
| आयरन | हेमेटाइट मेग्नेटाइट सिडेराइट | Fe2O3 Fe3O4 FeCO3 |
| कॉपर | कॉपर पाइराइट मेला काइट क्युप्राइट कॉपर ग्लान्स | CuFeS2 CuCO3.Cu(OH)2 Cu2O Cu2S |
| जिंक | जिंक ब्लेड या स्फेलेराइट कैलामाइन जिंकाइट | ZnS ZnCO3 ZnO |
Tagged with: General Principles and Processes of Isolation of Elements notes in hindi

Sir.
Mujhe loha , Aluminium, Zink, Couper, dhatu ka nishkrshan main dikkat ho raha hai.
So, apse request hai ki aap ine sabhi dhatuo ke nishkarshan wala notes bhej de. Pleas🙏🙏🙏
Class 12th chemistry.
Group me jald hi share kr dunga.
Chemistry
P black element
Good
Good website i am Muslim
No
My coaching problem
notes download nahi ho raha hai sir.
It is possible the document was deleted.likh Raha hai